INFORM 1: Interferon-freie HCV-Therapie
In INFORM-1 wird das Nukleosid R7128 mit hoher Resistenzbarriere mit dem Proteasehemmer R7227 mit niedriger Resistenzbarriere, aber hoher antiviraler Wirksamkeit, kombiniert. 86 therapienaive sowie vorbehandelte Patienten mit chronischer Hepatitis C Genotyp 1 nehmen teil.
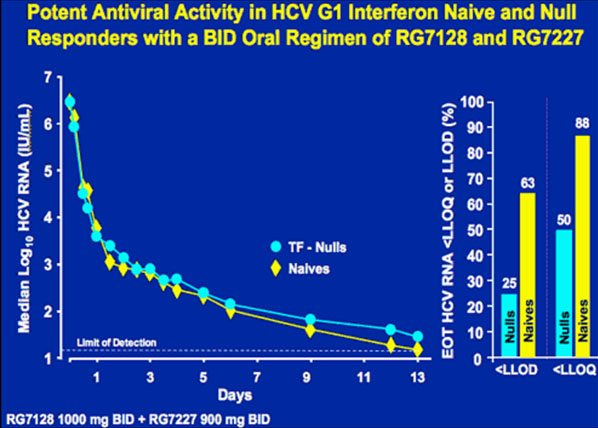
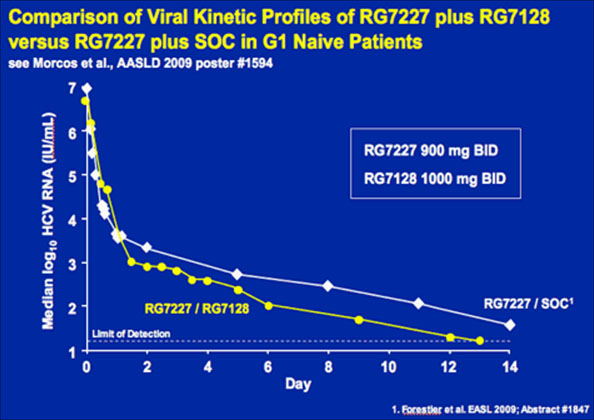
48/49 der Patienten hatten einen kontinuierlichen Abfall der Viruslast. Unter der höchsten Dosierung (Polymerasehemmer R1728 1000 mg plus Proteasehemmer R7227 600 mg BID) fiel die HCV-RNA innerhalb der ersten 14 Tage um 4,8 bis 5,2 log. Bei 63% der Patienten lag die HCV-RNA unter der Nachweisgrenze von 40 IU/ml.
Die Verträglichkeit war gut, kein Patient
brach wegen Nebenwirkungen ab und in keinem Fall musste die Dosierung reduziert
werden. Resistenzen wurden nicht beobachtet.
Die Studie wird in Neuseeland durchgeführt, da die amerikanische FDA eine direkt antivirale Therapie nur über 14 Tage erlaubt, da auftretende Resistenzen bei Nicht-Ansprechen weitere Therapieoptionen verbauen könnten.
Bei der Studie kooperieren die Unternehmen Roche, Pharmaset und InterMune.
Fazit
Die Interferon-freie Therapie hat die erste Hürde genommen. Die Kombination hat eine gute antivirale Wirksamkeit und wird auch gut vertragen. Vorteile im Vergleich zur Standardtherapie scheint neben der oralen Gabe auch die bessere Verträglichkeit zu sein.