Sofosbuvir (Sovaldi®)
400 mg Filmtablette
Indikation
Zugelassen zur Behandlung der chronischen Hepatitis C bei Erwachsenen in Kombination mit anderen Arzneimitteln.
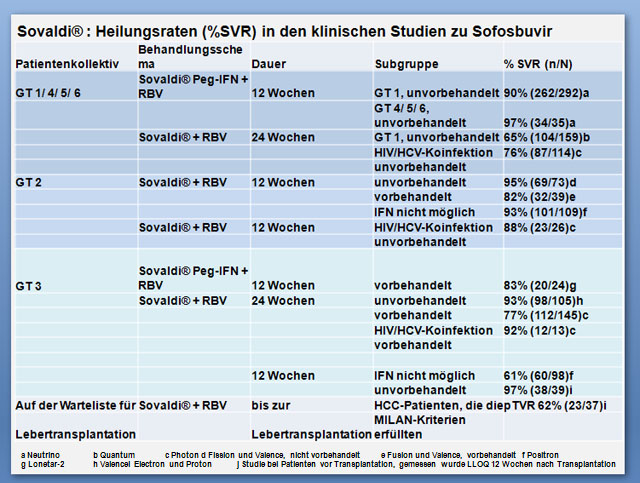
| Patientengruppe | Kombinationstherapie | Dauer |
|---|---|---|
| Patienten mit CHC vom Genotyp 1, 4, 5 oder 6 | Sofosbuvir + RBV + peg-IFN | 12 Wochen |
| |
Sofosbuvir + RBV nur zur Anwendung bei Patienten, die eine Kontraindikation gegenüber peg-IFN oder eine Interferon-Unverträglichkeit haben | 24 Wochen |
| Patienten mit CHC vom Genotyp 2 | Sofosbuvir + RBV | 12 Wochen |
| Patienten mit CHC vom Genotyp 3 | Sofosbuvir + RBV + peg-IFN | 12 Wochen |
| |
Sofosbuvir + RBV | 24 Wochen |
| Patienten mit CHC, die auf eine Lebertransplantation warten | Sofosbuvir + RBV | Bis zur Lebertransplantation |
Dosierung
Einmal eine Tablette 400 mg pro Tag zu einer Mahlzeit. Keine Dosisreduktion.
Verträglichkeit
Sofosbuvir ist sehr gut verträglich.
Wechselwirkungen
Arzneimittel, die starke p-gp-Induktoren sind (z.B. Rifampicin, Johanniskraut, Carbamazepin und Phenytoin) können den Sofosbuvir-Spiegel senken und sollten nicht gemeinsam angewandt werden.
Wirksamkeit
Wirksam gegen alle HCV-Genotypen.
Bewertung/Einordnung/Nutzen
Sofosbuvir ist ein Durchbruch in der Hepatitis C-Therapie. Es erhöht die Chancen auf eine Heilung bei allen Genotypen und ermöglicht in einigen Fällen eine Interferon-freie Behandlung. Die Einnahme ist sehr einfach und die Verträglichkeit ausgesprochen gut.
Die hier genannten Informationen wurden gewissenhaft erstellt. Eine Gewähr für die Richtigkeit der gemachten Angaben kann trotz aller Bemühungen NICHT übernommen werden!