The Livermeeting® 2011 – 4.-8.
November 2011 in San Francisco/USA
 Hepatitis C nach wie vor im Mittelpunkt
Hepatitis C nach wie vor im Mittelpunkt
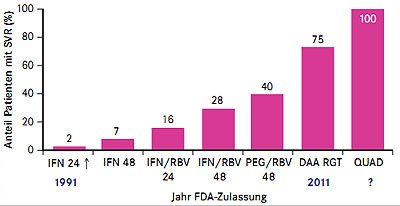
In diversen Subanalysen und Post-hoc Analysen der Boceprevir- und Telaprevir-Zulassungsstudien wurden verschiedene Einflussfaktoren unter anderem zu Ansprechen, Therapieversagen, Stoppregeln, Nebenwirkungen, unterschiedlichen Patientengruppen und Kosteneffektivität untersucht. Diese praxisrelevanten Daten und vor allem die Daten zu den neuen Substanzen wurden mit Spannung erwartet – die Vortragssäle der HCV-Sessions waren teilweise überfüllt und die jeden Tag wechselnden Poster-Sessions waren ebenfalls gut besucht. Bisher wurde bereits viel in der HCV-Therapie erreicht (Abb. 1) – nun werden Therapieregime entwickelt, die einfacher, möglichst einmal am Tag einzunehmen sind, weniger Nebenwirkungen hervorrufen, eine hohe Resistenzbarriere besitzen, kürzer eingenommen werden müssen und möglichst ohne Interferon auskommen. Ehe aber eine der neuen Substanzen oder Kombinationen die Marktreife erlangen, wird es wohl noch mindestens zwei bis drei Jahre dauern – Ergebnisse einer Phase-III-Studie gab es für keine der neuen DAAs. Aufgrund der Fülle der Daten konnten für diesen Bericht nur ein paar Schlaglichter berücksichtigt werden.
Boceprevir
Eine Subanalyse der Zulassungsstudien für therapienaive Patienten (SPRINT-2) und zuvor erfolglos behandelte Patienten (RESPOND-2) HCV-Genotyp 1 ergab, dass die Boceprevir-haltige Tripletherapie vergleichbar gut in Kombination mit häufig verschriebenen Medikamenten, einschließlich Methadon und Antidepressiva, vertragen wurde wie ohne diese Begleitmedikation; die Nebenwirkungsrate war bei gleichzeitiger Gabe von starken CYP3A4-Inhibitoren und CYP3A4-Substraten jedoch erhöht (Poordad F et al. #1342).
Die von der europäischen Zulassungsbehörde für therapienaive und zuvor erfolglos behandelte Patienten vereinheitlichten Stoppregeln – Viruslast ≥100 IU/ml Woche 12 und nachweisbar Woche 24 – haben sich in einer retrospektiven Analyse der Boceprevir-Zulassungsstudien bestätigt (Jacobson IM et al. #954). Mit dem Cut-off von 100 IU/ml zu Woche 12 erreichten therapienaive Patienten, deren Viruslast Woche 12 nachweisbar ist, aber unter 100 U/ml lag, eine SVR (sustained virological response: HCV-RNA auch 24 Wochen nach Ende der Therapie nicht nachweisbar, wird als Heilung angesehen). Patienten mit vorherigem Therapieversagen erzielten ebenfalls eine SVR, wenn die Viruslast Woche 12 unter 100 IU/ml lag, aber nachweisbar war – diese Patienten hätten mit der Studien-Stoppregel (>9,3 IU/ml) die Therapie vorzeitig beenden müssen.
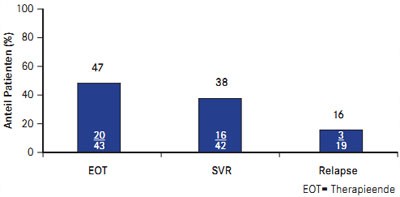
Abb. 2 PROVIDE: Boceprevir bei vorherigen Nullrespondern (nach Vierling JM et al. #931)
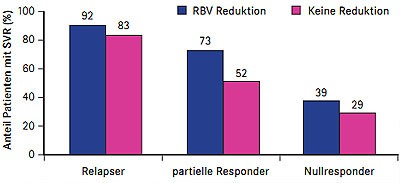
Abb. 3 REALIZE: Einfluss Ribavirin-Dosisreduktion bei Anämie unter Telaprevir (nach Roberts SK et al. #1368)
Auch Nullresponder profitieren von einer Boceprevir-basierten Tripletherapie, wie die Zwischenanalyse der nach wie vor laufenden offenen Studie PROVIDE ergab (Vierling JM et al. #931). Insgesamt 48 Nullresponder, die in SPRINT-2 und RESPOND-2 unter pegIFN/RBV ein Therapieversagen hatten, erhielten zunächst die vierwöchige Lead-in-Phase mit pegIFN/RBV und danach 44 Wochen lang Boceprevir plus pegIFN/RBV. Insgesamt 38% (16/42) der Patienten erreichten eine SVR und 16% (2/19) waren Relapser (Abb. 2).
Telaprevir
Eine Subanalyse der Studie REALIZE
(vorbehandelte Patienten HCV-Genotyp 1) untersuchte den Einfluss einer Anämie
und einer Dosisreduktion von Ribavirin auf die Heilungsrate (Roberts SK et al.
#1368). Die Ribavirin-Dosis wurde bei 133 von 532 (25%) Patienten unter Tripletherapie
und 16/132 (12%) unter pegIFN/RBV wegen einer Anämie verringert. Der Einfluss
der Dosisreduktion auf die SVR-Rate war zwar nicht signifikant, aber mehr
Patienten mit Anämie erzielten eine SVR mit versus ohne RBV-Dosisreduktion
(Abb. 3). Faktoren, die unter der Telaprevir-Tripletherapie das Risiko einer
Anämie erhöhten, waren höheres Alter, niedriger BMI, niedriger Hämoglobin-Wert
zu Baseline (jeweils p<0,001), fortgeschrittenere Fibrose (p=0,0369) und
Genotyp 1b versus 1a (p=0,011). Risikofaktoren für eine Anämie unter pegIFN/RBV
waren höheres Alter (p<0,0002) und niedriger Hämoglobin-Wert zu Baseline (p<0,0001).
Eine weitere Subanalyse von REALIZE ergab für Patienten mit Zirrhose (F4) eine SVR-Rate von 47% unter der Tripletherapie und 10% unter pegIFN/RBV (Pol S et al. #31). Bei den vorherigen Relapsern mit Zirrhose war die Heilungsrate am höchsten (84% vs.7%), gefolgt von den partiellen Respondern (34% vs.20%) und den Nullrespondern (14% vs. 10%).
Die erneute Behandlung mit Telaprevir könnte bei Patienten mit Therapieversagen unter Telaprevir aussichtsreich sein, denn die resistenten Viren verschwinden spontan innerhalb von einigen Jahren (Sarrazin C et al. #35). In der Roll-over Studie C219 erhielten 9 Patienten aus einer Phase-1-Studie, die unter Telaprevir keine SVR erreicht hatten, erneut eine Telaprevir-Tripletherapie. Bei 8/9 Patienten waren Resistenzen nachweisbar, die im Schnitt 5,7 Jahre nach der Telaprevir-Exposition in keinem Fall mehr nachweisbar waren. Acht Wochen nach erneuter Telaprevir-Therapie waren 6 von 9 der früheren Telaprevir-Versager HCV-RNA-negativ.
Kosteneffektivität
Ein wichtiges Thema war die Kosteneffektivität der neuen Therapieoptionen. So wurden für die Boceprevir-basierte Tripletherapie pro Woche 1.100 US-Dollar zu Grunde gelegt. Basierend auf den Studienergebnissen verringert sich das Lebenszeitrisiko mit der Tripletherapie für Leberkomplikationen um 41-46% bei therapienaiven und 48-59% bei vorbehandelten Patienten und die Patienten gewinnen qualitätskorrigierte Lebensjahre (QALYs) (Ferrante AS et al. #929 und Chhatwal J et al. #940). Beide Berechnungen ergaben, dass bei einer Schwelle von .000 die Tripletherapie kosteneffektiv ist. Frühere Berechnungen zu Telaprevir kamen ebenfalls auf diesen Wert (ACG 2011; P1105).
Die Berechnung des Duke Clinical Research Institutes, Durham/USA, ergab, dass bei HCV-Patienten mit Genotyp 1 und dem günstigen IL28B-Polymorphismus CC eine initiale Telaprevir-basierte Tripletherapie mit den derzeitigen Kosten und Wirksamkeitsdaten nicht kosteneffektiv ist (Gellad ZF et al. #118). Das Institut wird diese Berechnungen auch für Boceprevir und für beide Proteasehemmer auch für andere Patientengruppen durchführen.
Neue Proteasehemmer
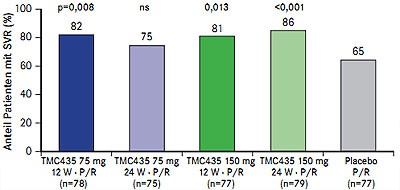
Abb. 4 PILLAR: SVR-Raten unter verschiedenen Dosierungen von TMC-435 (nach Fried MW et al. #LB-5)
Der einmal tägliche NS3/4A-Proteasehemmer TMC-435 war in der fünfarmigen Phase-IIb-Studie PILLAR (n=386; therapienaiv, Genotyp 1) in verschiedenen Dosierungen und mit unterschiedlicher Therapiedauer der Standardtherapie überlegen: SVR-Raten 75-86% im Vergleich zu 65% (Abb. 4) (Fried MW et al. #LB-5). Insgesamt 79-86% der Patienten konnten die Therapie auf 24 Wochen verkürzen und davon erreichten 93-96% eine SVR. Die Abbruchrate aufgrund einer Nebenwirkung war zwischen TMC-435 und Plazebo vergleichbar, ebenso die Inzidenz von Rash, Anämie und Neutropenie. Unter TMC-435 traten vorübergehende Hyperbilirubinämien auf die nicht mit Leberwerterhöhungen einhergingen. Für die Phase-III wurde die Dosierung 150 mg QD und eine 24-wöchige Tripletherapie ausgewählt.
Eine Tripletherapie mit dem NS3/4A-Proteasehemmer BI201335 120 mg QD erzielte in der Studie SILEN-C3 (n=159) mit 12 Wochen und 24 Wochen Therapiedauer (jeweils plus 24 Wochen pegIFN/RBV) vergleichbare Heilungsraten bei therapienaiven Patienten Genotyp 1(65% vs. 73%; n.s.) (Dieterich D et al. #36). Unter dem Proteasehemmer waren Rash, Anämie, gastrointestinale Nebenwirkungen und Hyperbilirubinämie nicht häufiger als unter pegIFN/RBV. Die Phase-III-Studien werden mit 120 mg QD und 240 mg ohne Lead-in-Phase durchgeführt.
Ritonavir als Booster
Der einmal tägliche NS3-Proteasehemmer Narlaprevir (ehemals SCH900518)kann einmal am Tag gegeben werden, wenn er mit dem HIV-Proteasehemmer Ritonavir geboostert wird. In der Dosisfindungsstudie NEXT-1 (n=111; therapie-naiv, Genotyp 1) wurden verschiedene Narlaprevir-Dosierungen mit und ohne Ritonavir und mit und ohne Lead-in-Phase untersucht und gegen pegIFN/RBV verglichen (Vierling JM et al. #LB-17). Mit 12 Wochen Narlaprevir 200 mg QD plus Ritonavir 100 mg QD gefolgt von 12 Wochen pegIFN/RBV wurde eine SVR-Rate von 85% erreicht.
Auch der makrozyklische NS3/4A-Proteasehemmer Danoprevir wird demnächst mit Ritonavir als Booster in der Phase III geprüft. In der vorgestellten Phase-II-Studie ATLAS (n=225, therapienaiv, Genotyp 1) war die Therapie mit 3x täglich 600 mg Danoprevir als 12-wöchige Tripletherapie gefolgt von 24 oder 36 Wochen pegIFN/RBV mit einer SVR-Rate von 85% und der niedrigsten Relapse-Rate (8%) von allen geprüften Dosierungen am wirksamsten (Terrault N et al. #79).
12 Wochen QUAD
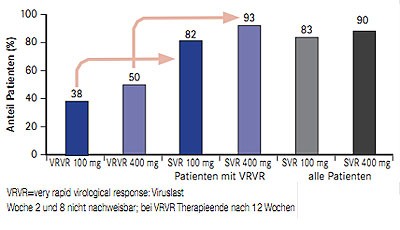
Abb. 5 ZENITH: SVR-Raten unter 12- und 24-wöchiger QUAD-Therapie mit VX-222, Telaprevir und pegIFN/RBV (nach Nelson DR et al. #LB-14)
In der Studie ZENITH werden unterschiedliche Therapieregime mit dem Polymerasehemmer VX-222 untersucht (n=152; therapienaiv, Genotyp1): VX-222 100 mg QD und 400 mg QD in Kombination mit Telaprevir TID zwölf Wochen lang mit und ohne pegIFN/RBV gefolgt von 24 bzw. 12 Wochen pegIFN/RBV sowie VX-222 100mg QD und 400 mg QD plus Telaprevir TID plus Ribavirin für 12 Wochen gefolgt von pegIFN/RBV für weitere 24 Wochen. Patienten, deren Viruslast zu Woche 2 und 8 nicht mehr nachweisbar war (VRVR,) konnten die gesamte Therapie nach nur 12 Wochen beenden. Die präsentierte Zwischenanalyse umfasst die SVR-Raten 12 Wochen nach Ende der Therapie (SVR-12) der QUAD-Therapie (100 mg VX-222 n=29 und 400 mg VX-222 n=30). Insgesamt 82% der Patienten mit einer VRVR unter der 12-wöchigen QUAD-Therapie mit VX-222 100 mg QD und 93% mit VX-222 400 mg QD erzielten eine SVR, bei Patienten ohne VRVR, d.h. mit 12 Wochen QUAD und anschließend 12 Wochen pegIFN/RBV betrug die SVR-Rate 83% bzw. 87% (Abb. 5) (Nelson DR et al. #LB-14).
Ohne Interferon, aber mit RBV
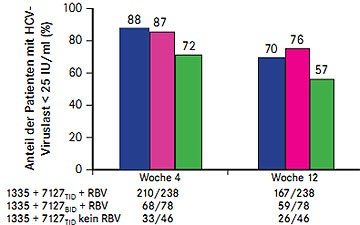
Abb. 6 SOUND-C2: Viruslast Woche 4 und Woche 12 unter BI201335 plus BI201127 plus Ribavirin (nach Zeuzem S et al. #LB-15)
Mit der Interferon-freien oralen Tripletherapie aus dem Proteasehemmer BI201335, dem Polymerasehemmer BI201127 und Ribavirin erreichten in der Studie SOUND-C2 bis zu 76% der Patienten nach 12 Wochen Therapie eine Viruslast unter der Nachweisgrenze, ohne Ribavirin waren es 57% (Abb. 6)(Zeuzem S et al. #LB-15). Insgesamt 362 Patienten mit HCV-Genotyp 1 wurden mit fünf verschiedenen Kombinationen behandelt: 120 mg QD BI201335 (1335) plus 600 mg TID BI207127 (7127TID) plus Ribavirin (RBV) für 16, 28 oder 40 Wochen oder 1335 + 600 mg BID BI207127 (7127BID) plus RBV für 28 Wochen oder 1335 + 7127 TID ohne RBV für 28 Wochen. In der vorgestellten Zwischenanalyse nach 12 Wochen war die Kombination 1335 QD plus 7127 BID plus RBV am wirksamsten.
Ob Interferon-alfa für eine SVR überhaupt nötig ist, war auch Fragestellung der Studie ELECTRON mit dem einmal täglichen Uridin-Nukleotidanalogon PSI-7977 plus Ribavirin (Gane EJ at al. #34). Jeweils 10 Patienten mit Genotyp 2 oder 3 erhielten für 12 Wochen 400 mg PS-7977 QD plus RBV und für 0, 4, 8 und 12 Wochen zusätzlich pegIFN. Unabhängig von einer pegIFN-Gabe sprachen alle 40 Patienten auf die duale 12-wöchige Therapie mit PSI-7977 plus Ribavirin rasch an (100% RVR = HCV-RNA Woche 4 nicht nachweisbar) und erreichten auch alle eine SVR (100% SVR). In der Studie PROTON (n=111; therapienaiv, HCV-Genotyp 1) erzielte die Tripletherapie PSI7977 200 mg QD bzw. 400 mg QD jeweils plus pegIFN/RBV für 12 Wochen gefolgt von pegIFN bei 88% bzw. 91% der Patienten 12 Wochen nach Ende der Therapie eine SVR (SVR-12); die Daten der SVR nach 24 Wochen stehen noch aus (Lawitz E et al. #225).
Duale DAA-Therapie ohne IFN
Neun von zehn japanischen Nullrespondern mit HCV-Genotyp 1b erreichten mit einer dualen Kombination aus dem NS5A-Inhibitor Daclatasvir (ehemals BMS-790052) und dem NS3-Proteaseinhibitor Asunaprevir (ehemals BMS-650032) eine SVR (Chayama K et al. #LB-4). In der nach wie laufenden offenen Phase-2a-Studie erhielten zunächst 10 Patienten für 24 Wochen 60 mg QD Daclatasvir und 200 BID Asunaprevir (die anfängliche Dosis von 600 mg BID wurde wegen erhöhter Leberwerte verringert). Neun Patienten hatten bereits Woche 8 eine nicht nachweisbare Viruslast und sprachen mit einer SVR an; auch die Patientin, die die Studie nach zwei Wochen abbrach (Gastroenteritis ohne Zusammenhang und Hyperbilirubinämie mit Zusammenhang mit der Studienmedikation), erreichte trotzdem noch eine SVR (Abb. 7). Die häufigsten Nebenwirkungen waren Diarrhoen und Kopfschmerzen Grad 1, drei Patienten hatten erhöhte Transaminasen Grad 1/2, ein Patient eine Pyrexie Grad 3 und ein Patient eine Hyperbilirubinämie Grad 4.
Abb. 7 Daclatasvir plus Asunaprevir bei Nullrespondern: virologisches Ansprechen unter und nach Therapie (nach Chayama K et al. #LB-4)
Hepatitis B
Neue Therapieansätze
MicroRNA-Inhibitor
Miravirsen inhibiert die leberspezifische microRNA-122, die für die HCV-Replikation eine zentrale Rolle spielt. In einer Proof-of-concept-Studie erhielten 36 therapienaive Patienten HCV-Genotyp 1 vier Wochen lang wöchentlich eine s.c. Injektion Miravirsen 3 mg, 5 mg oder 7 mg (Janssen HL et al. #LB-6). Nach sechs Wochen Follow-up zeigte sich eine dosisabhängige Abnahme der Viruslast, die auch 10 Wochen nach Therapiebeginn anhielt mit einer maximalen Abnahme von -2,73 Logstufen unter 7 mg Miravirsen. Die häufigsten Nebenwirkungen waren leichte Kopfschmerzen, Rhinitis und Diarrhoen. Der microRNA-Inhibitor soll als Monotherapie und in Kombination mit interferonfreien Therapieregimen weiter entwickelt werden.
Cyclophilin-Inhibitor
Der
Cyclophilin-Inhibitor Alisporivir (ehemals DEB025) wurden in unterschiedlichen
QD-Dosierungen und Kombinationen untersucht – 1.000 mg als Monotherapie, 600 mg
und 800 mg plus RBV, 600 mg plus pegIFN – und gegen pegIFN/RBV verglichen
(n=334, therapienaiv, HCV-Genotyp 2 und 3) (Pawlotsky J et al. #LB-11). 32-49%
der Patienten hatten mit den interferonfreien Regimen zu Woche 6 und 91-97% zu
Woche 12 eine nicht nachweisbare Viruslast. Patienten, die unter Alisporivir
keine RVR zu Woche 4 ohne
pegIFN erreichten, erhielten das Interferon und zu Woche 6 waren mindestens 90%
von ihnen HCV-RNA-negativ. Virale Durchbrüche waren selten. Eine
Hyperbilirubinämie trat bei 1,7% und ein Ikterus bei 2,4% Patienten unter
Alisporivir auf.
Silymarin oral – das Aus
Hochdosiertes orales Silymarin (Mariendistelextrakt) war bei Nonrespondern weder bio-chemisch noch virologisch wirksamer (Fried MW et al. #228). In der vom National Institute of Health (NIH) finanzierten doppelblinden, plazebokontrollierten Studie erhielten 154 vorbehandelte HCV-Patienten entweder Plazebo TID (n=52) oder Silymarin oral 400 mg TID (n=44) oder 700 mg TID (n=52) für 24 Wochen. Insgesamt sprachen nur 5 Patienten auf die Therapie an und unter dem Mariendistelextrakt verbesserten sich weder die ALT und die HCV-Viruslast noch die Lebensqualität signifikant im Vergleich zu Plazebo.
Der Schwerpunkt Hepatitis C stellte viele andere Indikationen, unter anderem auch Hepatitis B in den Schatten. Es gibt keine grundsätzlich neuen Therapieansätze für Hepatitis B, aber neue Daten zu den etablierten Medikamenten.
Leberzirrhose geht zurück
Eine Leberzirrhose kann sich unter einer langfristig erfolgreichen Therapie mit Tenofovir zurückbilden wie die Auswertung der beiden Zulassungsstudien 102 und 103 ergab (Marcellin P et al #1375). In den ersten 48 Wochen dieser beiden Studien wurde die Wirksamkeit von Tenofovir und Adefovir bei therapienaiven Patienten verglichen, danach erhielten alle Adefovir-Patienten Tenofovir. Von 641 Patienten führten 585 (91%) die Studie weiter und nach fünf Jahren nahmen noch 490 (75%) Patienten teil. Die HBV-DNA war zu diesem Zeitraum bei 83% der HBeAg-negativen Patienten (Studie 102) und 66% der HBeAg-positiven (Studie 103) Patienten nicht nachweisbar (<400 Kopien/ml) und bei 9% vs. 7% trat ein HBsAg-Verlust mit HBs-Serokonversion auf. Insgesamt 331 Patienten ließen sich zu Beginn der Studie und nach 240 Wochen biopsieren. Bei 88% der Patienten zeigte sich in der Leberbiopsie eine Verbesserung des histologischen Bildes (Verbesserung Knodell Nekroinflammations-Score ohne Verschlechterung des Knodell Fibrose-Scores). Von den 94 Patienten mit Zirrhose bei Studienbeginn (Ishak Fibrose-Score >5), kam es bei 69 (73%) zu einer Regression der Zirrhose und bei 68 (72%) zu einem Rückgang des Ishak Fibrose-Scores um mindestens 2 Punkte. Im Verlauf der fünf Jahre brachen 2,1% der Patienten die Therapie wegen Nebenwirkungen ab und bei 0,9% wurde ein Anstieg des Serum-Kreatinins um mindestens 0,5 mg/dl oder Abfall der berechneten Kreatininclearance um mindestens 50 ml/min dokumentiert. Kein Patient entwickelte eine Resistenz unter Tenofovir. Auch die 163 asiatischen Studienteilnehmern zeigten in der Leberbiopsie nach fünf Jahren Tenofovir-Therapie eine histologische Verbesserung, allerdings erreichte kein asiatischer Patient einen HBsAg-Verlust (Gane EJ et al. #1429).
Kombinieren nicht nötig
Die Kombination Entecavir und Tenofovir (n=197) ist bei therapienaiven Patienten mit chronischer HBV (70% HBsAg+) nicht wirksamer als die Monotherapie mit Entecavir alleine(n=182), so das Fazit der Phase-IIIb-Studie BE-LOW (Lok AS et al. #223). Nach 96 Wochen Therapie hatten 83,2% der Patienten aus dem Kombinations-Arm und 76,4% aus dem Monotherapie-Arm eine HBV-DNA-Viruslast von <50 IU/ml (n.s.) (Abb. 7). Allerdings gab es unter der Kombination tendenziell bessere Ergebnisse bei HBeAg-positiven Patienten mit einer hohen Virämie von ≥108 IU/ml bei Studienbeginn (78,8% vs. 62,0%).
HIV-Koinfektion
Tenofovir bei HIV/HBV
In einer retrospektiven französischen Studie wurden die Daten von 166 Patienten mit HIV/HBV-Koinfektion analysiert, von denen 15 die Therapie mit Tenofovir plus Lamivudin oder Emtricitabin begonnen hatten und 46 Patienten Tenofovir zusätzlich zu einer laufenden Lamivudin-Therapie erhielten (Lada O et al. #1428). Im Mittel nahmen die Patienten Tenofovir 46 Monate ein. Am Ende der Beobachtungsphase war die HBV- DNA von 5,9 Logstufen IU/ml zu Beginn auf <1,3 Logstufen IU/ml gesunken und lag bei allen Tenofovir-Patienten unter der Nachweisgrenze. Ein virologischer Durchbruch wurde nicht beobachtet. 22% der Patienten verloren HBeAg und 4% HBsAg. Der Serum-Kreatininspiegel hatte sich nicht verändert.
HBsAg-Spiegel prädiktiv
In einer holländischen Studie mit 104 HIV/HBV-Koinfizierten korrelierte der HBsAg-Verlust mit der Immunrekonstitution und dem HBsAg-Spiegel unter einer Langzeittherapie mit Tenofovir (Zoutendijk R et al. #1378). Zu Beginn war der HBsAg-Spiegel bei HBeAg-Positiven höher als bei HBeAg-Negativen (4,6 vs. 2,8 log IU/ml). Der HBsAg-Spiegel nahm bei den HBeAg-Positiven kontinuierlich ab, aber in geringerem Ausmaß als bei den HBeAg-Negativen. Bei ihnen korrelierte die Immunrekonstitution mit dem HBsAg-Abfall. Nach 56 Monaten hatten 12 (18%) der Patienten eine HBeAg-Serokonversion erreicht. Fünf HBeAg-positive (8%) und 3 HBeAg-negative (8%) Patienten verloren HBsAg. HBeAg-Positive mit einem HBsAg-Spiegel <100 IU/ml hatten eine Wahrscheinlichkeit von 70%, HBsAg zu verlieren.
Telaprevir bei HIV/HCV
Nun liegen auch die
24-Wochen-Daten zu Telaprevir bei HIV/HCV-Koinfektion vor: Eine nicht
nachweisbare Viruslast hatten zu diesem
Zeitpunkt 71% der Patienten unter Tripletherapie und 55% unter pegIFN/RBV
(Sherman KE et al. #LB-8). Im ersten Teil der Studie erhielten 13
HIV/HCV-Koinfizierte ohne HIV-Therapie und im zweiten Teil 47
HIV/HCV-Koinfizierte mit stabiler HIV-Therapie 12 Wochen lang Telaprevir oder
Plazebo plus pegIFN/RBV und anschließend für weitere 36 Wochen pegIFN/RBV. Die
HIV-Therapie bestand entweder aus Efavirenz (höhere Telaprevirdosis!) oder
Atazanavir/r jeweils kombiniert mit Tenofovir und Emtricitabin oder 3TC.

Fotos: Andrea Warpakowski