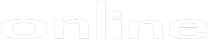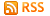Ramona Pauli, München
HCV-Proteasehemmer bei HIV/HCV-Koinfizierten
Die chronische Hepatitis C ist heute für die Langzeitprognose von HIV/HCV-Koinfizierten von größerer Bedeutung als die HIV-Infektion, denn die HIV-Infektion kann in den meisten Fällen gut kontrolliert werden, während die Lebererkrankung bei den Koinfizierten rascher voranschreitet als bei HCV-Monoinfizierten. Die SVR-Raten bei HIV/HCV-Koinfizierten Genotyp 1 bei Standardtherapie mit pegyliertem Interferon und Ribavirin sind trotz nunmehr gewichtsadaptierter Ribavirin-Dosierung und längerer Therapiedauer insgesamt noch unbefriedigend. Die neuen HCV-Proteasehemmer werden daher auch für HIV/HCV-Koinfizierte dringend gebraucht.
Interaktionen
Probleme beim Einsatz von Telaprevir und Boceprevir bei Koinfizierten bereiten insbesondere die Wechselwirkungen mit antiretroviralen Substanzen. Bei zu niedrigen Plasmaspiegeln der HCV-Proteasehemmer bzw. der HIV-Medikamente droht eine HCV- bzw. HIV-Resistenz. Nun hat aber die Mehrzahl der HIV-Patienten zum Zeitpunkt der HCV-Therapie bereits eine HIV-Medikation, zum Teil aufgrund des aktuellen Trends zu einem früheren Behandlungsbeginn bei der HIV-Infektion, zum Teil in Antizipation des Abfalls der CD4-Zellen unter HCV-Therapie.
Die Daten zu Interaktionen der HAART (hochaktive antiretrovirale Therapie) wurden und werden laufend aktualisiert. Interaktionen sind insbesondere bei Substanzen, die über das Enzymsystem CYP 450 verstoffwechselt werden zu erwarten (vergl. Beitrag Klinker S. 26). Telaprevir zeigt ein ausgeprägtes Interaktionspotential mit allen NNRTI und HIV-Proteasehemmern außer Atazanavir. Boceprevir scheint einem Poster auf dem AASLD zufolge zumindest mit dem NNRTI Efavirenz nicht zu interagieren.
Klinische Studien
Die Daten zu HCV-Proteasehemmern bei
HIV/HCV-Koinfizierten sind bislang spärlich. Derzeit liegen lediglich 24-Wochen
Daten zweier Phase-2-Studien vor. In der
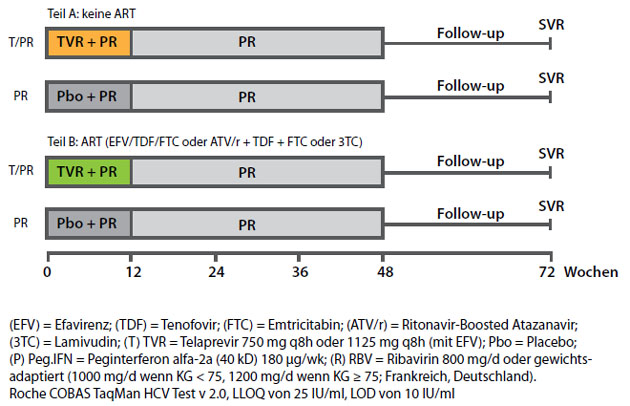
Telaprevir-Studie gab es vier Arme: HIV/HCV-Koinfizierte ohne
HIV-Therapie (n=13) Tripletherapie vs.
Standardtherapie und HIV/HCV-Koinfizierte mit stabiler HIV-Therapie (n=47)
Tripletherapie vs. Standardtherapie. Die Tripletherapie wurde wie bei der
HCV-Monoinfektion 12 Wochen lang gegeben, anschließend weitere 36 Wochen lang pegIFN/RBV. Eine Therapieverkürzung war nicht vorgesehen (Abb. 1).
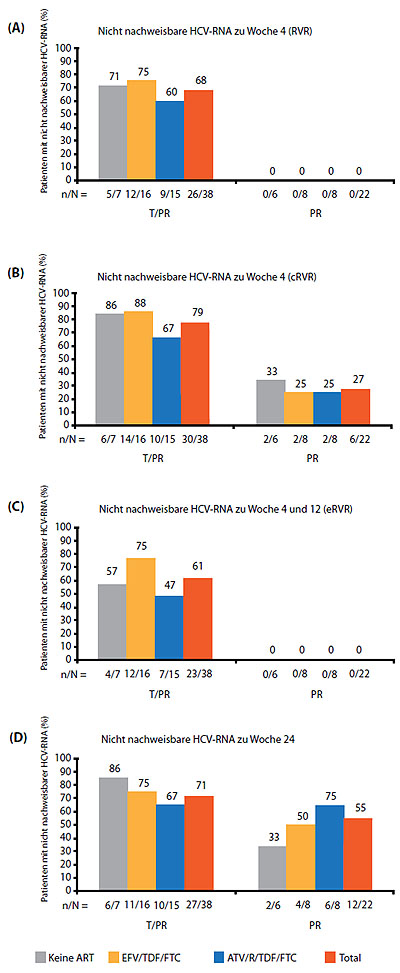
Abbildung 2: Tripletherapie mit Telaprevir vs Standardtherapie. Virologisches Ansprechen über 24 Wochen. Nach Sherman KE et al, AASLD 2011, Abstract LB-8
Die HIV-Therapie bestand entweder aus Efavirenz oder Atazanavir/r jeweils in Kombination mit Tenofovir und Emtricitabin oder 3TC. Bei gleichzeitiger Gabe von Efavirenz wurde die Telaprevirdosis von 3 x täglich 750 mg auf 3 x täglich 1125 mg erhöht. Beim geboosterten Atazanavir war keine Dosisanpassung not-wendig. Alle Patienten hatten bei Stu-dienbeginn einen guten Immunstatus (CD4-Zahl 690 bzw. 562/µl) und die HIV-Viruslast lag bei den unbehandelten Patienten bei 1400 bzw. 300 Kopien/ml und bei den behandelten Patienten unter der Nachweisgrenze. 92 % bzw. 81 % der Patienten hatten eine HCV-Viruslast von ≥ 800.000 IU/ml.
Eine RVR zu Woche 4 erreichten unter Tripletherapie insgesant 68 %, eine EVR zu Woche 12 79 % der Patienten im Vergleich zu 0 und 27 % unter Standardtherapie. Nach 24 Wochen hatten unter der Telaprevir-basierten Tripletherapie 7 % der Patienten und unter pegIFN/RBV allein 55 % der Patienten nach wie vor eine nicht nachweisbare HCV-Viruslast. Zwischen den Gruppen mit und ohne antiretroviraler Therapie bestanden keine großen Unterschiede (Abb. 2).
Ein HCV-Rebound unter Telaprevir wurde bei drei Patienten beobachtet, bei je einem Patienten unter Atazanavir und Efavirenz zu Woche 4 und bei einem Patienten unter Efavirenz zu Woche 12. Die Telaprevir-Plasmakonzentrationen wa-ren bei beiden HIV-Therapien vergleichbar, die Spiegel der HIV-Medikamente lagen im erwarteten Bereich.
Ein vergleichbar gutes Ergebnis wurde auch unter Boceprevir beobachtet. Im Unterschied zur Telaprevir-Studie hatten hier alle 98 Patienten eine antiretrovirale Therapie (Atazanavir/r, Lopinavir/r, Darunavir/r, Raltegravir, CCR5-Antagonist, NRTI, kein NNRTI, kein AZT, kein d4T) und alle hatten eine nicht nachweisbare HIV-Viruslast (HIV-RNA < 50 Kopien/ml). Vorgesehen ist das gleiche Therapieschema wie bei Monoinfektion (d.h. 4 Wochen Lead-in, 44 Wochen Tripletherapie) ohne die Möglichkeit der Therapieverkürzung (Abb. 3).
Nach 4-wöchigem Lead-in mit pegIFN/RBV allein und 4 Wochen Tripletherapie vs. Standardtherapie hatten zu Woche 8 in der Boceprevir-Gruppe 37 % vs 15 % in der Standardgruppe keine nachweisbare HCV-RNA. Zu Woche 12 waren es 56 % vs. 25 % und zu Woche 24 70 % vs. 34 %. Bei 70 % der Patienten war HCV zu Woche 24 nicht mehr nachweisbar (Abb. 4).
Verträglichkeit
Im Hinblick auf die Verträglichkeit gab es keine Überraschungen. Unter Telaprevir traten im Vergleich zu Placebo mehr Schmerzen im Abdomen, Erbrechen, Schwindel, Fieber, Depressionen und Juckreiz auf. Unter Atazanavir/r entwickelten sich häufiger Ikterus und Hyperbilirubinämie. Auch unter Boceprevir wurden keine unerwarteten Nebenwirkungen beobachtet. Folgende Ereignisse waren unter Tripletherapie mit Boceprevir häufiger als unter konventioneller Behandlung: Neutropenie (13 % vs 3 %), Geschmacksstörung (25 % vs 15 %), Erbrechen (25 % vs 15 %), Fieber (34 % vs 21%), Kopfschmerzen (28 % vs 12 %) und verminderter Appetit (28 % vs 12 %). Mehr Patienten brachen die Studie wegen unerwünschter Wirkungen ab (14 % vs 9 %). Schwere Nebenwirkungen waren unter Boceprevir jedoch seltener (8 % vs 21%).
Leitlinien
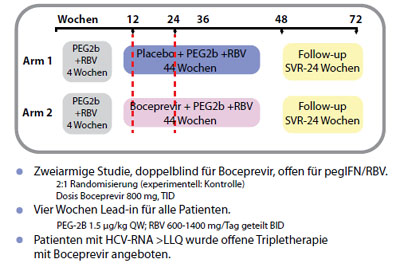
Abbildung 3: Tripletherapie mit Boceprevir vs Standardtherapie. Studiendesign. Nach Sulkowski M et al, IDSA 2011, Abstract LB-37.
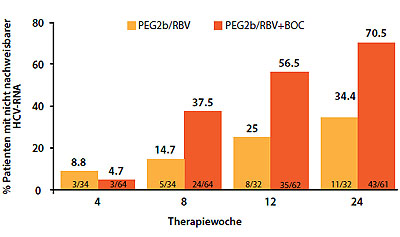
Abbildung 4: Tripletherapie mit Boceprevir vs Standardtherapie. Virologisches Ansprechen über 24 Wochen. Nach Sulkowski M et al, IDSA 2011, Abstract LB-37.
Laut den im Oktober 2011 aktualisierten Leitlinien der Europäischen Aids-Gesellschaft (EACS) sind pegyliertes Interferon und Ribavirin immer noch Therapie der Wahl bei HIV/HCV-Koinfizierten. Es wird jedoch darauf hingewiesen, dass Studien zur Tripletherapie laufen und zum Zeitpunkt der Publikation der Leitlinien nur 12-Wochen-Daten zu Telaprevir vorlagen. Dementsprechend wird in den Leitlinien nur Telaprevir als mögliche Option erwähnt. Adaptierungen nach Studienlage seien aber zu erwarten. Empfohlen werden 12 Wochen Tripletherapie mit Telaprevir gefolgt von 36 Wochen pegIFN/RBV ohne Möglichkeit zur Therapieverkürzung. Die Stopp-Regeln sind wie bei HCV-Monoinfektion.
Einsatz in der Praxis
Nachdem im Zulassungstext der Einsatz der neuen HCV-Proteasehemmern bei HIV/HCV-Koinfizierten nicht ausdrücklich ausgeschlossen ist und die europäischen Leitlinien die Möglichkeit der Tripletherapie mit Telaprevir erwähnen, gibt es keine formale Hürde für den Einsatz von HCV-Proteasehemmern bei HIV/HCV-Koinfizierten. In den Leitlinien wird Telaprevir explizit erwähnt, da die Daten zu Boceprevir bei Erstellung der Leitlinien nicht bekannt waren. Es wird jedoch gleichzeitig darauf verwiesen, dass Aktualisierungen nach Publi-kation der Boceprevir-Daten folgen werden.
Angesichts der spärlichen Daten, der vielen Interaktionen und möglichen Gefahren einer Resistenzentwicklung sowohl von HCV als auch von HIV sollte man die Tripletherapie noch zurückhaltend, nur bei ausgewählten Patienten und mit der gleichen antiretroviralen Medikation wie in den Studien einsetzen. Es empfiehlt sich, zunächst nicht Patienten mit fortgeschrittener Leberfibrose/Zirrhose zu behandeln. Diese Patienten brauchen zwar die Heilung der chronischen Hepatitis am dringendsten, sie haben aber auch unter Tripletherapie die geringste Chance auf eine SVR.
Literatur
Sherman KE et al. Telaprevir Combination with Peg-interferon Alfa-2a/Ribavirin in HCV/HIV Coinfected Patients: 24-Week Treatment Interim Analysis.
62nd Annual Meeting of the American Association of the Study of the Liver (AASLD) 2011; Hepatology 2011, Abstract LB-8.
Sulkowski M et al. Boceprevir plus Peginterferon/Ribavirin for the treatment of HCV/HIV co-infected patients: interim on-treatment results.
49th Annual Meeting of the Infectious Diseases Society of America, Boston, abstract LB-37, 2011.
Poordad F et al. Concomitant Medication Use (drug interactions) in Patients with Hepatitis C Genotype 1 Treated with Boceprevir Combination Therapy. 62nd Annual Meeting of the American Association of the Study of the Liver (AASLD) 2011; Hepatology 2011, Abstract 937.