ROBERT THIMME, FREIBURG
Immunantwort bei Hepatitis B
Die Immunantwort gegen das Hepatitis B Virus (HBV) ist ganz wesentlich für den Ausgang der natürlichen Infektion sowie für den Erfolg der Impfung verantwortlich. Bei beiden Prozessen spielen aber unterschiedliche Komponenten der Immunantwort eine entscheidende Rolle. So sind HBV-spezifische T-Zellen wesentlich für die Viruselimination und die Pathogenese der natürlichen Hepatitis B Virusinfektion verantwortlich, während Antikörper eine große Bedeutung bei der Vermittlung des Vakzine-vermittelten Schutzes haben.
Die Komponenten des Immunsystems spielen bei der Viruskontrolle unterschiedlich große Rollen. So ergaben Genexpressionsanalysen (sog. microarrays) im Lebergewebe experimentell infizierter Schimpansen, dass das angeborene Immunsystem bei der HBV-Infektion erst gar nicht induziert wird.1 Die humorale Immunantwort wird im Rahmen der akuten Infektion induziert und nach Ausheilung der Infektion kommt es zur Bildung von Antikörpern gegen das HBsAg (anti-HBs). Diese haben in vitro neutralisierende Eigenschaften und vermitteln in vivo eine sterilisierende Immunität, schützen also effektiv vor einer (Re-)Infektion.
ZELLULÄRE IMMUNANTWORT
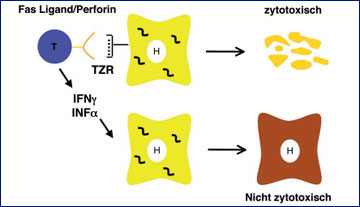
Abb. 1: Zytotoxische und nicht-zytotoxische Effektorfunktion von CD8+ T-Zellen. CD8+ T-Zellen erkennen Antigene über ihren T-Zellrezeptor (TZR), die ihnen an HLA-Klasse I-Moleküle gebunden präsentiert werden. Sie können zum einen über Fas/Fas-Ligand-Interaktion bzw. Perforinsekretion virusinfizierte Zellen zerstören (oben) und zum anderen über die Sekretion von antiviralen Zytokinen wie z.B. Interferon-γ oder Tumor-Nekrose-Faktor-α zur Viruselimination ohne Zerstörung der infizierten Zelle beitragen.
Während die angeborene und humorale Immunantwort bei der HBV-Infektion eher eine untergeordnete Rolle aufweist, hat die zelluläre Immunantwort bei der Viruskontrolle eine entscheidende Bedeutung.2 CD4+ T-Zellen erkennen virale Antigene, die ihnen von Antigenpräsentierenden Zellen (u.a. Dendritische Zellen) über HLA-Klasse-II-Moleküle präsentiert werden. Aktivierte CD4+ T-Zellen können dann unterschiedliche Komponenten des Immunsystems wie z.B. Makrophagen, B-Zellen und insbesondere CD8+ T-Zellen induzieren und werden daher häufig als T-Helfer-Zellen bezeichnet. CD8+ T-Zellen erkennen hingegen virale Antigene, die von infizierten Zellen über HLA-Klasse-I-Moleküle präsentiert werden. Die Effektorfunktion von CD8+ T-Zellen umfasst zwei verschiedene Mechanismen. Zum einen können sie die infizierten Zellen direkt abtöten, weshalb CD8+ T-Zellen auch häufig als zytotoxische T-Zellen bezeichnet werden. Zum anderen können CD8+ T-Zellen aber auch durch die Sekretion antiviraler Zytokine wie z.B. Interferon-γ oder Tumor-Nekrose-Faktor-α zur Viruselimination beitragen, ohne die infizierte Zellen abzutöten (Abb. 1).
Grundlagen Immunsystem
Die Immunantwort auf Virusinfektionen wird von verschiedenen Komponenten des angeborenen sowie erworbenen Immunsystems vermittelt. Zum angeborenen Immunsystem gehören neben physikalischen und chemischen Barrieren (z.B. Haut und Schleimhaut bzw. Magensäure) Entzündungszellen wie z.B. Granulozyten, Makrophagen und Natürliche Killerzellen (NK-Zellen), die u.a. Zytokine und Chemokine wie z.B. Interferon-α und - β sezernieren. Das erworbene Immunsystem setzt sich aus dem humoralen Immunsystem (Antikörperproduzierende B-Zellen bzw. Plasmazellen) sowie dem zellulären Immunsystem (CD4+ und CD8+ T-Lymphozyten) zusammen.
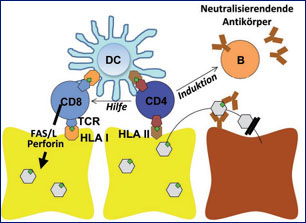
Komponenten der adaptiven Immunantwort
Bereits einige Wochen nach der Virusinfektion sind Virus-spezifische CD4+ und CD8+ T-Zellen im peripheren Blut nachweisbar und reichern sich kurz danach in der Leber an. Dies ist einerseits mit der Lebererkrankung (erhöhte Transaminasen) sowie andererseits mit der Elimination des Virus assoziiert. Die CD4+ und CD8+ T- Zellantworten sind dabei stark und multispezifisch, also gegen mehrere T-Zell-Epitope gerichtet, und persistieren nach der Viruselimination.3-7 Durch Depletionsstudien konnte die zentrale Bedeutung von CD8+ T-Zellen nachgewiesen werden, so bleibt das Virus in der Abwesenheit von CD8+ Zellen auf maximalen Titern.8 Erst mit dem Wiederauftreten von CD8+ T-Zellen im peripheren Blut und der Leber kommt es zu einer Reduktion der Virusmenge und der Auslösung der Lebererkrankung. Diese Ergebnisse zeigen, dass CD8+ T-Zellen ganz entscheidend für die Viruselimination und Pathogenese der akuten HBV-Infektion sind. Das Virus selbst ist nicht pathogen für die Hepatozyten, solange keine Immunzellen anwesend sind.
CHRONISCHE INFEKTION
Während bei der akuten selbst-limitierten HBV-Infektion die CD4+ und CD8+ T-Zellantworten stark und multispezifisch sind, zeichnet sich die chronische Infektionsphase durch schwache und mono- oder oligospezifische T-Zellantworten aus. Bei der chronischen HBV-Infektion fehlen T-Zellantworten - abgesehen von sogenannten Flares - häufig ganz. Allerdings konnte für die chronische HBV-Infektion gezeigt werden, dass die T-Zellantwort eine gewisse Viruskontrolle vermitteln kann. So weisen Patienten mit normalen Transaminasen, einer niedrigen Viruslast und negativem HBeAg meist einen relativ hohen Anteil an intrahepatischen, Virus-spezifischen T-Zellen auf. Bei Patienten mit erhöhten Transaminasen, einer hohen Viruslast und positivem HBeAg lassen sich zwar etwa gleich viele T-Zellen in der Leber nachweisen; hiervon ist jedoch nur ein kleiner Anteil Virus-spezifisch.9
MECHANISMEN DES IMMUNVERSAGENS
Abb. 2: T-Zellen (blau angefärbt). Wissenschaftlern der Charite in Berlin ist es kürzlich gelungen, aus "einfachen" T-Helferzellen langlebige Gedächtniszellen zu machen
Die Mechanismen, die zum Versagen der Immunantwort und somit Persistenz des Virus beitragen, sind bisher nur sehr wenig bekannt. Verschiedene Ursachen werden diskutiert, wie z.B. ein mangelndes priming von naiven T-Zellen, d. h. es wird erst gar keine Virus-spezifische T-Zellantwort ausgebildet, oder es kommt im Lauf der Infektion zu einer T-Zellerschöpfung der Virus-spezifischen T-Zellen.2 Zudem kann die Anreicherung von Virus-spezifischen T-Zellen in der Leber, dem primären Ort der Virusreplikation, gestört sein (defektes homing). Neben diesem quantitativen T-Zellversagen weisen die Virus-spezifischen T-Zellen bei der chronischen HBV-Infektion auch funktionelle Defekte auf. Diese T-Zelldysfunktion kann die T-Zellproliferation, ihre Zytotoxizität oder aber die Sekretion von antiviralen Zytokinen betreffen.10 Die Ursache für dieses Versagen ist nicht genau bekannt, obwohl einige neuere Arbeiten auf eine höhere Expression des inhibitorischen Rezeptors PD-1 und andere auf eine hohe Expression des pro-apoptotischen Proteins Bim hinweisen.1, 11 Weiterhin wurde eine hemmende Wirkung von regulatorischen T-Zellen aufgezeigt.12 Im Gegensatz zur HCV-Infektion spielt das Auftreten von viralen Escapemutanten, die durch Sequenzvariationen im Bereich von T-Zellepitopen den entsprechenden T-Zellantworten entkommen, bei der HBV-Infektion nur eine untergeordnetere Rolle.2
THERAPIE UND T-ZELL ANTWORT
Interessanterweise haben einige Studien zeigen können, dass eine antivirale Therapie der chronischen Hepatitis B mit einer Erholung der Virus-spezifischen Immunantwort assoziiert ist. Das Wiederauftreten der Virus-spezifischen T-Zellen erfolgte zeitgleich mit einer starken Therapie-induzierten Senkung der Viruslast.13, 14 Diese Ergebnisse lassen zwei wichtige Schlussfolgerungen zu. Erstens, eine hohe Virämie trägt direkt zur Suppression der Virus-spezifischen T-Zell Antwort bei. Zweitens, die Virus-spezifischen T-Zellen werden bei der chronischen HBV-Infektion nicht komplett eliminiert, sondern können rasch wieder proliferieren, sobald das Virus kontrolliert wird. Diese Ergebnisse könnten ggf. bei einer therapeutischen Vakzinierung genutzt werden, indem vor einer Vakzinierung die Viruslast durch eine antivirale Therapie gesenkt wird.
VAKZINE-INDUZIERTE IMMUNANTWORT
Im Rahmen einer aktiven Immunisierung wird sowohl eine zelluläre als auch eine humorale Immunantwort induziert, wobei der primär protektive Effekt auf den Antikörpern beruht. Alle Impfstoffe gegen HBV enthalten HBsAg, das Oberflächenprotein von HBV. Der Schutz vor Infektion ist an das Vorhandensein von anti-HBs gebunden. Die Dauer dieses Schutzes vor Infektion entspricht damit der Zeit, während der eine anti-HBs Konzentration über dem als Schutzgrenze definierten Wert von 10 IE/ L vorhanden ist. Interessanterweise haben aber Langzeituntersuchungen an Geimpften zeigen können, dass bei Personen, die auf eine Grundimpfung gut angesprochen hatten, auch über das Vorhandensein messbarer Antikörper hinaus ein Schutz vor einer klinisch manifesten Erkrankung besteht. In diesen Fällen kann es zwar nach dem Verschwinden von anti-HBs und deren protektiven Wirkung zu einer Infektion kommen, diese wird dann aber durch eine durch die Impfung induzierte immunologische Gedächtnis T-Zell Antwort rasch eliminiert. Tatsächlich lassen sich bei allen geimpften Patienten auch nach dem Verschwinden von anti-HBs spezifische T-Zellen und B-Zellen nachweisen.15 Die T-Zellen vermitteln dabei keinen Schutz vor einer Infektion, können aber eine Ausbreitung des Virus durch die Leber und somit eine symptomatische Erkrankung verhindern. Es ist bisher unklar, ob dieser Schutz lebenslang anhält.
IMMUNANTWORT UND HCC
Hepatozelluläres Karzinom (HCC)
Ca. 1% der Patienten mit chronischer HBV-Infektion entwickeln ein hepatozelluläres Karzinom (HC). Über die molekularen Mechanismen, die zur HCC-Entstehung auf dem Boden einer chronischen HBV-Infektion beitragen, ist bisher nur wenig bekannt. Diskutiert werden sowohl virale (z.B. Gentransaktivierung) als auch wirtseigene Faktoren. Typischerweise tritt das HCC erst nach mehreren Jahren oder Jahrzehnten auf dem Boden einer chronischen Hepatitis auf. Somit kann vermutet werden, dass durch den chronischen Entzündungsprozess, der wie beschrieben, durch Virus-spezifische und unspezifische T-Zell Antworten ausgelöst und unterhalten wird, das prokarzinogene Umfeld und die HCC-Entstehung induziert wird. Unterstützt wird diese Hypothese durch Untersuchungen in einem Mausmodell mit chronisch immunvermittelter Lebererkrankung.16 Hierzu wurden HBV-transgene Mäuse thyemktomisiert, bestrahlt und mit Knochenmarks- und Milzzellen von syngenen, nicht transgenen Mäusen rekonstituiert. Die Immunzellen wurden vor der Rekonstitution mit HBsAg stimuliert und zeigten so eine HBV-spezifische T-Zell Aktivität. Die Rekonstitution mit syngenen Immunzellen ist notwendig, da die T-Zellen der HBV-transgenen Mäuse gegenüber HBV tolerant sind. Nach der Rekonstitution kam es bei allen Mäusen zu einer kurzen Episode einer akuten Hepatitis und anschließend zur Ausbildung einer chronischen Hepatitis mit den typischen histologischen Zeichen. Langfristig entwickelte sich bei allen Mäusen ein HCC. Diese Ergebnisse zeigen, dass eine chronische und ineffiziente Virus-spezifische T-Zell Antwort wesentlich zur HCC-Entstehung beitragen kann. Wahrscheinlich stellt der chronische Entzündungsprozess einen prämaligen Zustand dar, der eine Kaskade von verschiedenen molekularen Mechanismen in Gang setzt (z.B. erhöhte DNA-Syntheserate, Versagen von Reparatursystemen). Bleibt die Entzündung genügend lange bestehen, so führt sie zu den verschiedenen genetischen und chromosomalen Veränderungen, die für die Entstehung des HCC verantwortlich sind. Diese Ergebnisse unterstützen somit auch das Konzept, über eine Hemmung der Entzündung im Rahmen einer antiviralen Therapie ein Fortschreiten der Lebererkrankung zu verhindern.
FAZIT FÜR DIE PRAXIS
Virus-spezifische T-Zellen spielen eine entscheidende Rolle im klinischen Verlauf der HBV-Infektion. Während starke und multispezifische T-Zellantworten mit einer Viruselimination assoziiert sind, ist die T-Zellantwort in der chronischen Infektionsphase meist schwach, trägt aber wesentlich zu der chronischen Entzündung bei, die langfristig bis zum hepatozellulären Karzinom führen kann. Verschiedene Mechanismen tragen zu dem Versagen der Immunantwort und somit zur Viruspersistenz bei. Ein besseres Verständnis der Mechanismen des T-Zellversagens während der chronischen Infektion ist Grundvoraussetzung für die erfolgreiche Entwicklung von therapeutischen Immunstrategien.
Literatur
1. Wieland, S., Thimme, R., Purcell, R.H., and Chisari, F.V. 2004. Genomic analysis of the host response to hepatitis B virus infection. Proc Natl Acad Sci U S A 101:6669-6674.
2. Wieland, S.F., and Chisari, F.V. 2005. Stealth and cunning: hepatitis B and hepatitis C viruses. J Virol 79:9369-9380.
3. Boettler, T., Panther, E., Bengsch, B., Nazarova, N., Spangenberg, H.C., Blum, H.E., and Thimme, R. 2006. Expression of the interleukin-7 receptor alpha chain (CD127) on virus-specific CD8+ T cells identifies functionally and phenotypically defined memory T cells during acute resolving hepatitis B virus infection. J Virol 80:3532-3540.
4. Maini, M.K., Boni, C., Ogg, G.S., King, A.S., Reignat, S., Lee, C.K., Larrubia, J.R., Webster, G.J., McMichael, A.J., Ferrari, C., et al. 1999. Direct ex vivo analysis of hepatitis B virus-specific CD8(+) T cells associated with the control of infection. Gastroenterology 117:1386-1396.
5. Rehermann, B., Ferrari, C., Pasquinelli, C., and Chisari, F.V. 1996. The hepatitis B virus persists for decades after patients‘ recovery from acute viral hepatitis despite active maintenance of a cytotoxic T-lymphocyte response. Nat Med 2:1104-1108.
6. Rehermann, B., Fowler, P., Sidney, J., Person, J., Redeker, A., Brown, M., Moss, B., Sette, A., and Chisari, F.V. 1995. The cytotoxic T lymphocyte response to multiple hepatitis B virus polymerase epitopes during and after acute viral hepatitis. J Exp Med 181:1047-1058.
7. Rehermann, B., Lau, D., Hoofnagle, J.H., and Chisari, F.V. 1996. Cytotoxic T lymphocyte responsiveness after resolution of chronic hepatitis B virus infection. J Clin Invest 97:1655-1665.
8. Thimme, R., Wieland, S., Steiger, C., Ghrayeb, J., Reimann, K.A., Purcell, R.H., and Chisari, F.V. 2003. CD8(+) T cells mediate viral clearance and disease pathogenesis during acute hepatitis B virus infection. J Virol 77:68-76.
9. Maini, M.K., Boni, C., Lee, C.K., Larrubia, J.R., Reignat, S., Ogg, G.S., King, A.S., Herberg, J., Gilson, R., Alisa, A., et al. 2000. The role of virus-specific CD8(+) cells in liver damage and viral control during persistent hepatitis B virus infection. J Exp Med 191:1269-1280.
10. Das, A., Hoare, M., Davies, N., Lopes, A.R., Dunn, C., Kennedy, P.T., Alexander, G., Finney, H., Lawson, A., Plunkett, F.J., et al. 2008. Functional skewing of the global CD8 T cell population in chronic hepatitis B virus infection. J Exp Med 205:2111-2124.
11. Lopes, A.R., Kellam, P., Das, A., Dunn, C., Kwan, A., Turner, J., Peppa, D., Gilson, R.J., Gehring, A., Bertoletti, A., et al. 2008. Bim-mediated deletion of antigen-specific CD8 T cells in patients unable to control HBV infection. J Clin Invest 118:1835-1845.
12. Franzese, O., Kennedy, P.T., Gehring, A.J., Gotto, J., Williams, R., Maini, M.K., and Bertoletti, A. 2005. Modulation of the CD8+-T-cell response by CD4+ CD25+ regulatory T cells in patients with hepatitis B virus infection. J Virol 79:3322-3328.
13. Boni, C., Bertoletti, A., Penna, A., Cavalli, A., Pilli, M., Urbani, S., Scognamiglio, P., Boehme, R., Panebianco, R., Fiaccadori, F., et al. 1998. Lamivudine treatment can restore T cell responsiveness in chronic hepatitis B. J Clin Invest 102:968-975.
14. Boni, C., Penna, A., Ogg, G.S., Bertoletti, A., Pilli, M., Cavallo, C., Cavalli, A., Urbani, S., Boehme, R., Panebianco, R., et al. 2001. Lamivudine treatment can overcome cytotoxic T-cell hyporesponsiveness in chronic hepatitis B: new perspectives for immune therapy. Hepatology 33:963-971.
15. Bauer, T., and Jilg, W. 2006. Hepatitis B surface antigen-specific T and B cell memory in individuals who had lost protective antibodies after hepatitis B vaccination. Vaccine 24:572-577.
16. Nakamoto, Y., Guidotti, L.G., Kuhlen, C.V., Fowler, P., and Chisari, F.V. 1998. Immune pathogenesis of hepatocellular carcinoma. J Exp Med 188:341-350.