NICOLE FORESTIER, CHRISTOPH SARRAZIN
Aktuelle Entwicklungen bei der HCV-Therapie
Als hoffnungsvollste Perspektive für eine Verbesserung des Therapieansprechens bei chronischer Hepatitis C gelten derzeit spezifisch antivirale Substanzen gegen HCV, die gegenwärtig in klinischen Studien evaluiert werden. Das Therapieprinzip gilt als gesichert, es gibt jedoch noch einige Probleme zu lösen, z.B. Schwierigkeiten bei der Verträglichkeit und Nebenwirkungen sowie der Resistenzprobleme. Dennoch kann man erwarten, dass mit Hilfe dieser Substanzen mehr Patienten in kürzerer Zeit geheilt werden können, möglicherweise sich sogar mit Relapser und Nonresponder effektive Therapieoptionen ergeben.
| Entwicklungen bei der Therapie der chronischen Hepatitis C | ||
|---|---|---|
| Name | Entwickler | Klinische Phase |
| Lang wirksame Interferone | ||
| Albinterferon | Human Genome Sciences/Novartis | Phase 3 |
| Locteron | Biolex/Octoplus | Phase 2 |
| Ribavirin | ||
| Taribavirin | Valeant Pharmaceuticals | Phase 2 |
| „Specifically targeted antiviral therapy (STAT-C)” I. NS3/4 Serin-Protease Inhibitoren |
||
| Ciluprevir (BILN 2061) | Boehringer Ingelheim | Gestoppt |
| Telaprevir (VX-950) | Vertex | Phase 2/3 |
| Boceprevir (SCH 503034) | Schering-Plough | Phase 2/3 |
| ITMN-191 | InterMune | Phase 1 |
| TMC 435350 | Tibotec/JJ | Phase 2 |
| GS9132/ACH-806 | Gilead Sciences/Achillion | Gestoppt |
| II. NS5B RNA-abhängige RNA-Polymerase Inhibitoren A. Nukleosidanaloga |
||
| Valopicitabine (NM283) | Idenix/Novartis | Gestoppt |
| R1626 (prodrug of R1479) | Roche | Phase 2 |
| R1656/R7128 | Pharmasset/Roche | Phase 1 |
| XTL-2125 | XTL-Biopharmaceuticals | Gestoppt |
| MK-608 | Merck | Präklinisch |
| B. Nicht-Nukleosidanaloga | ||
| HCV-796 | ViroPharma/Wyeth | Gestoppt |
| BILB 1941 | Boehringer Ingelheim | Gestoppt |
| A-837093 | Abbott | Präklinisch |
| GS-9190 | Gilead | Phase 1 |
| III. NS5A Inhibitoren | ||
| A-831 | Arrow Therapeutics/AstraZeneca | Phase 1 |
| A-689 | Arrow Therapeutics/AstraZeneca | Präklinisch |
| IV. Cyclophilin Inhibitoren | ||
| DEBIO-25 | Debiopharm | Phase 1 in HCV/HIV co-infizierten Patienten |
| NIM811 | Novartis | Präklinisch |
Mit der gegenwärtig zugelassenen Standardtherapie mit Peginterferon alfa in Kombination mit Ribavirin kommt es lediglich in ca. 40-50% der Fälle zu einer dauerhaften Viruseradikation.1, 2 Die Therapie ist zusätzlich mit erheblichen Nebenwirkungen assoziiert, so dass die Entwicklung neuer Therapieoptionen auf eine verbesserte Wirksamkeit sowie Verträglichkeit abzielt. Durch die Entwicklung eines HCV-Zellkultursystems und auf der Grundlage einer genauen Kenntnis der Struktur der HCV-Proteine, ist es in den letzten Jahren möglich geworden, spezifische antivirale Substanzen zu entwickeln (STAT-C, specifically targeted antiviral therapy for HCV). Derzeit befinden sich zahlreiche neue direkt antivirale Substanzen in früher klinischer Erprobung (Phase 1-3) (Tab. 1).
AKTUELLE STANDARDTHERAPIE
Die aktuell zugelassene Standardtherapie bei der chronischen Hepatitis C besteht aus der kombinierten Gabe von Peginterferon alfa (Peg-IFN) und Ribavirin (RBV). Im Verlauf der letzten Jahre konnte es zu einer deutlichen Verbesserung der dauerhaften virologischen Ansprechraten kommen. Dies wurde zum einen durch eine zunehmende Individualisierung der Therapiedauer und der Dosierung der Medikamente und zum anderen durch ein verbessertes Management der Therapienebenwirkungen erreicht. Neben dem HCV-Genotyp ist vor allem das initiale virologische Ansprechen (Viruskinetik) der entscheidende Faktor, an dem sich die individualisierte Therapie ausrichtet. Somit konnte durch eine Therapieverlängerung von 48 Wochen auf 72 Wochen bei Patienten mit HCV-Genotyp 1 und einem langsamen virologischen Ansprechen (HCV-RNA zu Woche 12 noch positiv und Negativierung bis Woche 24 der Therapie) die Relapse-Raten signifikant reduzieren.3 Bei Patienten mit HCV-Genotyp 1, niedriger Ausgangsviruslast und einem raschen virologischen Ansprechen (RVR, HCV-RNA negativ zu Therapiewoche 4) zeigte sich dagegen, dass eine Verkürzung der Therapie von 48 auf 24 Wochen möglich ist, ohne dass es zu einer Reduktion der hohen dauerhaften Ansprechraten (ca. 90%) bei diesen Patienten kommt.4
Patienten mit HCV-Genotyp 2 oder 3 sprechen in der Regel besser auf die Standardtherapie an. Ausgehend von einer Standardtherapiedauer von 24 Wochen wurde bei diesen Patienten überprüft, ob unter bestimmten Bedingungen eine kürzere Therapiedauer ausreichend ist. In kleineren Studien zeigte sich, dass eine Therapiedauer von 12-16 Wochen unter der Voraussetzung eines raschen virologischen Ansprechens (RVR) ausreichend ist.5, 6 In einer folgenden, großen, multizentrischen Studie (ACCELERATE) konnte die Möglichkeit einer Verkürzung der Therapiedauer auf 16 Wochen bei Erreichen eines RVR nicht grundsätzlich bestätigt werden. Vielmehr muss zusätzlich eine niedrige Ausgangsviruslast vorliegen (<800.000 IU/ml), damit es zu keiner Verringerung der Ansprechraten kommt.7 Bei Patienten ohne RVR wird gegenwärtig der Wert einer über 24 Wochen hinaus verlängerten Therapie in prospektiven Studien ermittelt.8
WEITERE ENTWICKLUNG INTERFERONE
Albinterferon
Albinterferon ist eine neue langwirksame Form des Interferon-alfa. Durch eine genetische Fusion des Interferons an Humanalbumin wird eine sehr lange Halbwertzeit erreicht, so dass 2-4 wöchige Dosisintervalle möglich sind.
Albinterferon wird aktuell in zwei randomisierten, multizentrischen Phase-3-Studien in Kombination mit Ribavirin untersucht und könnte nach einem erfolgreichen Abschluss der Studien als Alternative zu den vorhandenen langwirksamen Interferon (Peg-Interferon alfa 2a und 2b) zugelassen werden.
Sonstige Interferone
Weitere Entwicklungen zur Verbesserung des Interferons zielen auf eine Modifikation der immunmodulierenden Effektivität sowie auf Alternativen zum Erreichen einer langanhaltenden Wirksamkeit. Die verschiedenen Substanzen finden sich bisher lediglich in Phase 1/2-Studien.
Interferon-omega, weist eine 70%ige Homologie zu Interferon alfa auf und soll über eine Pumpe über 3 Monate gleichmäßig appliziert werden. Locteron ist ein rekombinantes Interferon alfa welches durch ein spezielles System verzögert linear freigesetzt wird, so dass eine 2-wöchentliche Applikation möglich wäre. Hyperglykolisiertes Interferon erhält seine verlängerte Wirksamkeit über eine verstärkte Glykolisierung und soll eine effektivere Rezeptorbindung aufweisen. Beim pegyliertes Interferon lambda wird die Wirkdauer herkömmlich über eine Pegylisierung erreicht, während die immunmodulatorische Wirksamkeit durch die Verwendung von Interferon lambda optimiert werden soll. Beloferon schließlich ist ein oral verfügbares Interferon mit einem Aminosäurenaustausch an einer Position. In Tiermodellen konnte gezeigt werden, dass Beloferon vom Intestinum ins Blut aufgenommen wird und damit gleiche Konzentrationen im Blut erreicht wie bei subkutaner Injektion. Phase 1-Studien wurden bisher noch nicht initiiert.
WEITERE ENTWICKLUNGEN RIBAVIRIN
Taribavirin (bekannt auch als Viramidin) ist ein sogenanntes Prodrug, dass erst in der Leber zu Ribavirin umgewandelt wird. Dadurch kommt es zu einer wesentlich geringeren Aufnahme durch rote Blutkörperchen und in der Folge zu einer verringerten Anämie. In Phase 3-Studien war eine einheitliche Dosierung von Taribavirin jedoch Ribavirin mit niedrigeren Ansprechraten signifikant unterlegen. Gegenwärtig werden körpergewichtsadaptierte Dosierungen von Taribavirin in Phase 2-Studien untersucht.9
DIREKT ANTIVIRALE SUBSTANZEN (STAT-C) - PROTEASEINHIBITOREN
Ciluprevir (BILN 2061)
| BILN 2061 | Telaprevir | Boceprevir | ITMN-191 | |
|---|---|---|---|---|
| in vitro | R155Q A156V/T D168V/A/Y |
V36M/G/A T54A/S R155K/T A156S/V/T |
T54A A156S/T V170A |
V23A Q41R S138T D168A/V/E D168V/A156S/V S489L |
| in vivo | Keine Daten | V36M/A T54A/S R155K/T A156S/V/T |
V36M/A T54A/S R155K/T A156S/T V170A |
Keine Daten |
Ciluprevir war der erste HCV-spezifische NS3/4A Serin-Proteaseinhibitor. In klinischen Phase 1-Studien zeigte sich eine hohe antivirale Aktivität bei HCV Genotyp 1 Patienten.10 Bei Infektion mit Genotyp 2 oder 3 fand sich jedoch eine wesentlich geringere Wirksamkeit, was aufgrund der hohen Variabilität des Hepatitis C-Virusgenoms ein generelles Problem bei NS3/4A Proteaseinhibitoren darstellen könnte.11 Die weitere Entwicklung wurde aufgrund von Kardiotoxizitäten im Tierversuch gestoppt. Ein weiteres Problem bei der Therapie der Hepatitis C mit direkt antiviralen Substanzen stellt eine mögliche Resistenzentwicklung dar, wie sie in der Zellkultur für Ciluprevir nachweisbar war (Tab. 2).12
Telaprevir (VX-950)
Resistenzentwicklung
 Resistance
to telaprevir: Monotherapy - Mutationen, die unter der Therapie mit TVR beschrieben wurden Sarrazin et
al., Gastroenterology 2007
Resistance
to telaprevir: Monotherapy - Mutationen, die unter der Therapie mit TVR beschrieben wurden Sarrazin et
al., Gastroenterology 2007
Die RNA-Polymerase des Hepatitis C Virus hat eine relativ hohe Fehlerrate bei der Replikation. Deshalb werden während jedem Replikationszyklus verschiedene HCV-Varianten generiert. Durch die Behandlung mit antiviralen Substanzen können sich durch den Selektionsdruck die resistenten Varianten weiter vermehren. Dieses potentielle Problem der direkt antiviralen Substanzen wurde bereits in ersten Studien beschrieben und stellt eine Limitation der Heilungschancen dar. Aus diesem Grund müssen Konzepte zur Vermeidung einer Resistenzentwicklung, z.B. durch die Kombination mit PEG-Interferon, Ribavirin, sowie unterschiedliche direkt antiviral wirksame Substanzen entwickelt werden. Die mögliche Langzeitpersistenz der resistenten Mutanten ist derzeit noch unklar. Bei der großen Mehrzahl der Patienten, die unter einem Proteasehemmer Resistenzen entwickelten, war innerhalb von wenigen Monaten nach Absetzen der Substanz wieder der Wildtyp die dominante Virusvariante. Ob die resistenten Mutanten archiviert werden und bei erneuter Gabe der Substanz wieder auftauchen, ist bislang ungeklärt. Nach aktuellem Wissenstand ist das möglich, daher ist man mit weiteren Therapieversuchen mit der gleichen Substanz zurückhaltend. Die wenigen Patienten mit Persistenz der resistenten HCV-Mutanten werden derzeit beobachtet.
Telaprevir ist ein hochspezifischer peptidomimetischer Inhibitor der NS3/4A-Protease. In einer Phase 1b-Studie wurden Patienten mit HCV-Genotyp 1 für 14 Tage in einem randomisierten Protokoll entweder mit 450 mg oder 750 mg alle 8 Stunden oder 1.250 mg alle 12 Stunden behandelt. Unter der Behandlung mit Telaprevir zeigten die Patienten mit der 750 mg Dosierung den besten mittleren Abfall der HCV-RNA von 4.4 log1013. Bei einigen Patienten kam es unter der Therapie zu einer Resistenzentwicklung mit einem viralen Durchbruch. Bei diesen Patienten konnten Telaprevir-resistente Mutationen mit unterschiedlichen Resistenzniveaus nachgewiesen werden (Tab. 2).14 Virusvarianten mit einer resistenten Mutation zeigten typischerweise ein umgekehrtes Verhalten von replikativer Fitness und Resistenzniveau, d.h. die Varianten mit höherer Resistenz sind weniger fit.
Nach Ende der Therapie mit Telaprevir wurden die resistenten Mutationen innerhalb von drei bis sieben Monaten nach Therapieende weitestgehend wieder durch den Wildtyp ersetzt.14 Diese Patienten werden derzeit weiter beobachtet.
In einer weiteren Phase 1b-Studie wurde die Effektivität auch hinsichtlich der Verhinderung einer Resistenzentwicklung und die Sicherheit von Telaprevir in Kombination mit Peginterferon alfa-2a überprüft. In dieser Studie wurden 20 therapienaive Patienten mit HCV-Genotyp 1 für 14 Tage randomisiert entweder mit Telaprevir (n=8), Telaprevir+Peginterferon alfa-2a (n=8) oder Peginterferon alfa-2a+Placebo (n=4) behandelt. Der mittlere Abfall der HCV-RNA Konzentrationen betrug 3.99 log10 IU/ml in der Telaprevir-Gruppe, 5.49 log10 IU/ml in der Telaprevir+Peg-IFN-Gruppe und 1.09 log10 IU/ml in der Peg-IFN+Place-bo-Gruppe.15 Neben einer zumindest additiven Steigerung der antiviralen Aktivität zeigte sich auch eine signifikante Verminderung der Resistenzentwicklung, da trotz nachweisbarer resistenter Mutationen zu Beginn der Behandlung ein kontinuierlicher Abfall der HCV-RNA in der Kombinationstherapie aus Telaprevir und PEG-Interferon nachweisbar war.16
Nach der zweiwöchigen Studientherapie wurde allen Patienten anschließend die Weiterbehandlung mit der Standardtherapie aus PegIFN alfa-2a und RBV angeboten. Zu Therapiewoche 24 war bei allen Patienten, die initial mit Telaprevir behandelt wurden, die HCV-RNA im Serum negativ.17
Für die weitere Entwicklung von Telaprevir in der Phase 2-Studie liegen nun aktuell die abschließenden Ergebnisse der Studien PROVE-1 und -2 vor. PROVE-1 wurde in USA bei therapienaiven Patienten mit HCV-Genotyp 1 durchgeführt. Die Patienten wurden in vier verschiedene Therapiearme randomisiert:
- 12 Wochen mit Telaprevir (750 mg alle 8 Stunden) in Kombination mit Peg-IFN und RBV.
- 12 Wochen mit Telaprevir (750 mg alle 8 Stunden) in Kombination mit Peg-IFN und RBV, danach 12 Wochen mit Peg-IFN und RBV.
- 12 Wochen mit Telaprevir (750 mg alle 8 Stunden) in Kombination mit Peg-IFN und RBV, danach 36 Wochen mit Peg-IFN und RBV.
- 48 Wochen mit Peg-IFN und RBV (Kontrollarm).
Aus den Therapiearmen mit 12 bzw. 24 Wochen Therapiedauer wurde die Therapie nur dann beendet, wenn ein schnelles virologisches Ansprechen zu Therapiewoche 4 (HCV-RNA negativ) vorlag, alle anderen Patienten wurden für 48 Wochen weiterbehandelt.
Die PROVE-2 Studie wird in Europa durchgeführt und hat ein ähnliches Design wie die PROVE-1 Studie. Bei PROVE-2 ist der 12-Wochen-Arm mit Telaprevir, PegIFN und RBV mit anschließend 36 Wochen PegIFN und RBV ersetzt durch einen Arm mit 12 Wochen Telaprevir mit PegIFN. Ein wichtiger Unterschied zwischen beiden Studien ist, dass die Patienten aus PROVE-2 entsprechend ihren Therapiearmen vorgesehen die Therapie beenden konnten, ohne das Kriterium eines schnellen virologischen Ansprechens gehabt zu haben.
Die dauerhaften virologischen Ansprechraten 24 Wochen nach Therapieende waren am höchsten mit 67% in dem 12-Wochen-Triplearm mit anschließend 36 Wochen Standardtherapie. Vergleichbar hohe dauerhafte Ansprechraten mit 61% wurden in dem Arm mit 12 Wochen Triple-Therapie mit anschließend 12 Wochen Standardtherapie erreicht. Im Vergleich dazu lagen die dauerhaften Ansprechraten im Kontrollarm ohne Telaprevir bei 41% bei einer Therapiedauer von 48 Wochen.18 Diese Ergebnisse deuten darauf hin, dass bei Patienten mit HCV-Genotyp 1 durch eine Triple-Therapie mit Telaprevir gleichzeitig eine Reduktion der Therapiedauer auf 24 Wochen und eine signifikante Steigerung der dauerhaften virologischen Ansprechraten erreichbar ist.
Durch die Gabe von Telaprevir kam es zu zusätzlichen Nebenwirkungen und insgesamt häufiger zu Therapieabbrüchen mit 9% im Vergleich zu dem Kontrollarm mit einer Abbruchrate von nur 3%. Gastrointestinale Beschwerden, Hautausschläge und Anämien traten häufiger in den Telaprevir-Armen als im Kontrollarm auf.18
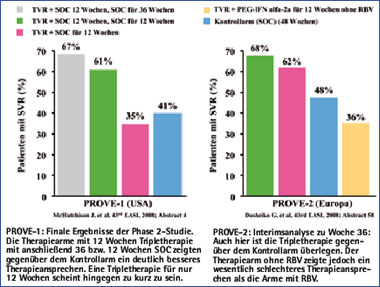
Abb. 1: Ergebnisse der PROVE-1 und -2 Studien
Zur PROVE-2 Studie wurden die Ansprechraten 12 Wochen nach Therapieende berichtet. Auch hier kommt es mit einer Reduktion der Therapiedauer auf 24 Wochen zu einer signifikanten Steigerung der dauerhaften Ansprechraten im Vergleich zum Kontrollarm (68 vs 48%). Weiterhin konnte nachgewiesen werden, dass auf die Gabe von Ribavirin für ein höheres Ansprechen unter Therapie als auch niedrige Relapseraten nicht verzichtet werden kann. Schließlich zeigt der Vergleich der PROVE- 1 und -2 Studien, dass Patienten mit einem raschen Ansprechen zu Woche 4 (HCV-RNA negativ) und Verkürzung der Therapiedauer auf insgesamt 24 Wochen, niedrigere Relapseraten aufweisen als Patienten ohne rasches Ansprechen.19 Die Ergebnisse der Studien PROVE-1 und -2 sind in Abbildung 1 zusammengefasst.
Neben PROVE-1 und PROVE-2 wird derzeit in der PROVE-3 Studie überprüft, ob eine Triple-Therapie mit Telaprevir, Peg-IFN und RBV auch bei Patienten, die bisher auf eine Interferontherapie nicht angesprochen haben (Relapser und Nonresponder), zu einer dauerhaften Viruseradikation führen kann. In einer kürzlich veröffentlichten Pressemitteilung von Vertex wurden erste Ergebnisse dieser Studie bekannt gegeben. Insgesamt kam es bei 52% aller Patienten zu einer SVR 12 bei einer Behandlungsdauer von 24 Wochen. Bei den Relapsen zeigten 73% eine SVR 12 und bei den NR 41%. Phase 3-Studien bei therapienaiven Patienten zur Zulassung von Telaprevir haben begonnen.
Boceprevir (SCH 503034)
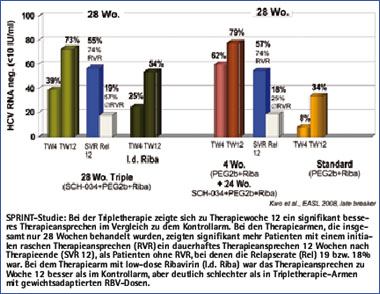
Abb. 2: Interimsanalyse SPRINT-1 Studie
Boceprevir ist ebenfalls ein peptidomimetischer HCV-Proteaseinhibitor mit reversibler Bindung an die NS3 Protease und antiviraler Aktivität im Replikonsystem.20
In einer Phase 1b-Studie wurde in einem Cross-Over Design Boceprevir alleine und in Kombination mit Peginterferon alfa-2b bei Patienten mit HCV-Genotyp 1, die auf eine vorangegangene Therapie mit Interferon nicht angesprochen haben (Nonresponder), evaluiert.21
Die Patienten wurden bezüglich unterschiedlicher Sequenzfolgen der Therapie und gegen Placebo randomisiert: (1) Boceprevir (200 mg oder 400 mg alle 8 Stunden) als Monotherapie für 7 Tage, (2) Peginterferon alfa-2b (1,5 mg/kg/w) als Monotherapie für 14 Tage und (3) Boceprevir plus Peginterferon alfa-2b für 14 Tage in einem 3 Perioden Cross-over Design mit einer 2-wöchigen Auswaschphase dazwischen. Die mittleren Abfälle der HCV-RNA unter Therapie betrugen in dem Arm mit Peginterferon alfa-2b und Boceprevir mit 200 mg bzw. 400 mg -2,45 ± 0,22 und -2,88 ± 0,22 verglichen mit -1.08 ± 0,22 und -1,61 ± 0,21 in dem Boceprevir-Armen mit 200 mg bzw. 400 mg und einem mittleren HCV-RNA Abfall in der Peginterferongruppe von -1,08 ± 0,22 bzw. -1,26 ± 0,20.21
Basierend auf den Ergebnissen dieser Studie wurde eine größere Phase 2-Studie bei Nonresponder-Patienten mit unterschiedlicher Dosierung von Boceprevir mit und ohne Ribavirin durchgeführt. Während der Therapie erfolgte eine Protokollanpassung, da sich herausstellte, dass die Gabe von Ribavirin unverzichtbar und die höchste Dosierung von 3x 800 mg Boceprevir am effektivsten ist. Die Ergebnisse aus dieser Studie wurden kürzlich auf dem EASL Kongress 2008 in Mailand vorgestellt und zeigen eine maximale dauerhafte Ansprechrate von 14% mit Boceprevir in der Tripletherapie plus Peg-Interferon und Ribavirin gegenüber 2% im Peg-Interferon/Ribavirin-Kontrollarm.22
In einer weiteren Phase 2-Studie wird gegenwärtig die Effektivität und Sicherheit von Boceprevir in Kombination mit Peginterferon alfa-2b und Ribavirin bei therapie-naïven Patienten evaluiert. In einer aktuellen Interimanalyse zeigt sich ein dauerhaftes Ansprechen von 55 bzw. 57% nach einer 28-wöchigen Tripletherapie bzw. einer 24-wöchigen Tripletherapie, wenn 4 Wochen Standardtherapie mit Peg-Interferon und Ribavirin vorgeschaltet wurde (Abb. 2).23 Die Zwischenergebnisse der Studie sind in Abbildung 2 zusammengefasst.
Auch die Gabe von Boceprevir ist mit zusätzlichen Nebenwirkungen (gastrointestinale Beschwerden, Anämie) und einer möglichen Resistenzentwicklung (Tab. 2) assoziiert.
ITMN-191
ITMN-191 ist ein weiterer NS3/4A Proteaseinhibitor, der ähnlich wie Ciluprevir eine makrozyklische chemische Struktur aufweist. Im Replikonsystem wurden bereits mehrere resistente Mutationen, die in Tabelle 2 aufgelistet sind, beschrieben. Im Mai 2007 wurde eine Phase 1a-Studie in gesunden Probanden beendet und eine Dosiseskalationsstudie Phase 1b bei Patienten mit HCV-Genotyp 1 initiiert. Die ersten im Internet aus einer Pressemitteilung von Intermune publizierten Daten zeigten für eine Gruppe von therapie-naiven Patienten, die 200 mg ITMN-191 alle 8 Stunden erhielten, eine mittlere Reduktion der HCV-RNA von 3,9 log10 IU/ml bei guter Verträglichkeit nach einer Behandlungszeit von 14 Tagen. Aktuell wird ITMN-191 in einer weiteren Phase 1b-Studie auf Effektivität und Sicherheit in Kombination mit Peginterferon alfa-2a und Ribavirin evaluiert.
TMC 435350
TMC 435350 ist ebenfalls ein makrozyklischer NS3/4A Serin-Proteaseinhibitor. In einer Phase 1a/1b-Studie wurde die Sicherheit und Effektivität von TMC 435350 evaluiert. Während einer 5-tägigen Behandlung mit 200 mg täglich kam es zu einer mittleren Reduktion der HCV-RNA von 3,9 log10 IU/ml bei Patienten, die auf eine Interferon-basierte Therapie nicht angesprochen haben. Insgesamt wurde TMC 435350 gut vertragen und zeigte eine antivirale Effektivität.24 Aktuell wird die Substanz in einer Phase 2-Studie in Kombination mit Peginterferon alfa-2a und Ribavirin evaluiert.
POLYMERASEINHIBITOREN
Bei den Inhibitoren der RNA-abhängigen RNA-Polymerase (NS5B Protein) werden nukleosidische Polymeraseinhibitoren mit Bindung im aktiven Zentrum und nicht-nukleosidische Inhibitoren mit Bindung an allosterischen Regionen unterschieden.
NUKLEOSIDISCHE POLYMERASEINHIBITOREN
Valopicitabin (NM283)
Valopicitabin wurde in Kombination mit Peginterferon bei Patienten mit HCV-Genotyp 1, die auf eine Interferontherapie nicht angesprochen haben, geprüft. Unter der 14-tägigen Therapie mit Dosierungen von 50 bis 800 mg/Tag kam es zu einer mittleren Reduktion der HCV-RNA von 0,15 bis 1,21 log10 IU/ml.25 Insgesamt wurde die Kombinationstherapie relativ gut vertragen, in höheren Dosen kam es jedoch zu erheblichen gastrointestinalen Nebenwirkungen. Deshalb wurde die maximale Dosis von 800 auf 400 mg reduziert. In einer Interimanalyse bei Patienten, die bisher noch keine Interferontherapie erhalten haben, kam es unter der Therapie mit Valopicitabin und Peginterferon alfa-2a zu einem mittleren Abfall der HCV-RNA von 3,90 bis 4,56 log10 IU/ml bzw. von 3,75 bis 4,41 log10 IU/ml nach 24 bzw. 36 Behandlungswochen allerdings ohne signifikante Steigerung im Vergleich zum Kontrollarm.26
In einer weiteren Studie wurden Patienten, die auf eine Interferontherapie nicht angesprochen haben, für 48 Wochen mit Valopicitabin in Kombination mit Peginterferon alfa-2a behandelt. Nach 48 Wochen Therapie war die mittlere Reduktion der HCV-RNA zwar mit 0,8 log10 IU/ml in der höchsten Dosierungsstufe höher als im Arm mit Peginterferon alfa-2a und Ribavirin, jedoch war dieser Unterschied nicht signifikant.21, 27 Aufgrund dieser Resultate und dem Nebenwirkungsprofil ist die weitere Entwicklung dieser Substanz gestoppt.
Interaktionen insbesondere zwischen verschiedenen nukleosidischen Substanzen könnten in Zukunft ein Problem darstellen. Es konnte gezeigt werden, dass Ribavirin in vitro die antivirale Aktivität von 20-C-Methylcytidin (aktiver Metabolit von Valopicitabin) antagonisiert. Dies könnte eventuell auch weitere Substanzen aus dieser Klasse betreffen.28
R1626
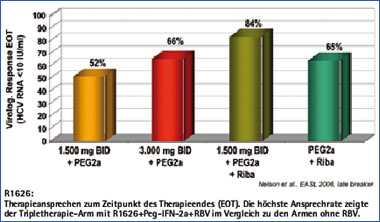
Abb. 3: Interimsanalyse Phase 2a-Studie mit R1626 + Peg-2a +/- RBV
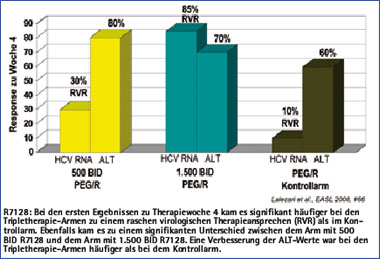
Abb. 4: Interimsanalyse Phase 2 R7128 + Peg-2a + RBV
R1626 ist eine Vorstufe von R1479, einem potenten Inhibitor der NS5B-abhängigen RNA Polymerase. In einer Phase 1-Dosis-eskalationsstudie wurde die Wirksamkeit und Sicherheit von R1626 bei therapie-naiven Patienten mit HCV-Genotyp 1 getestet. In der Untersuchung wurden die Patienten in unterschiedliche Dosierungsarme mit Dosen zwischen 500 und 4.500 mg zweimal täglich für insgesamt 14 Tage randomisiert. Die mittleren Abfälle der HCV-RNA betrugen 1.2, 2.6 und 3.7 log10 IU/ml in den Gruppen mit 1.500, 3.000 und 4.500 mg.
In einer kürzlich vorgestellten Phase 2a-Studie konnten durch die initiale Gabe von R1626 in Kombination mit Peg-Interferon und Ribavirin gefolgt von einer Standardkombinationstherapie virologische Ansprechraten zum Therapieende von bis zu 84% erreicht werden (Abb. 3).29
Allerdings kam es in den bisherigen Studien bei bis zu 78% der Patienten unter der Behandlung mit R1626 zu einem nach Absetzen reversiblen Abfall der neutrophilen Granulozyten unter 500/µl, so dass aktuell in einer laufenden Phase 2-Studie zur Evaluation einer Triple-Kombinationsstudie mit R1626, Peg-Interferon und Ribavirin, R1626 bzw. Peg-Interferon aktuell in niedrigeren Dosen gegeben werden.
PSI-6130 und R7128
R7128 ist eine Vorstufe von PSI-6130, einem nukleosidischen Polymeraseinhibitor. In bisherigen Phase 1-Studien zeigte sich eine gute antivirale Aktivität von R7128 bei guter Verträglichkeit mit einem virologischen Ansprechen in der Tripletherapie und negativer HCV-RNA nach 4 Wochen von bis zu 85% (Abb. 4).30
Weitere Studien zur Kombinationstherapie von R7128 mit Peg-Interferon und Ribavirin bei Patienten mit einer Genotyp 1 als auch 2, 3 Infektion wurden begonnen. Resistenzen unter Therapie wurden in den bisher durchgeführten Studien weder für R1626 noch für R7128 beobachtet.

Frage an Prof. Stefan Zeuzem, Frankfurt:
Wann werden die neuen spezifisch antiviralen Medikamente zur Therapie der chronischen Hepatitis C zur Verfügung stehen?
Die neuen STAT-C Medikamente stehen derzeit nur im Rahmen klinischer Studien zur Verfügung. Eine Zulassung und Verfügbarkeit auf Rezept wird - falls keine Probleme in den Zulassungsstudien auftreten - nicht vor 2011/12 erwartet. Mit einem beschleunigten Zulassungsverfahren ist weder bei therapienaiven Patienten noch bei vorbehandelten Patienten zu rechnen. Die spezifisch antiviralen Substanzen stellen eine neue Substanzklasse dar. Zudem wurde erstmals die Entwicklung von Resistenzen beschrieben, deren Langzeitfolgen noch unklar sind. Aus diesem Grund sind die Zulassungsbehörden eher zurückhaltend und fordern insbesondere aussagekräftige Daten zur Resistenz. Kombinationen verschiedener antiviraler Medikamente werden vermutlich noch später auf den Markt kommen.
NICHTNUKLEOSIDISCHE POLYMERASEINHIBITOREN
HCV-796
HCV-796 wurde nach mittleren antiviralen Aktivitäten in der Phase 1-Studie und einer Phase 2-Studie in Kombination mit Peginterferon alfa-2b und Ribavirin evaluiert. Unter der Therapie kam es bei 8% der Patienten zu einer Erhöhung der Leberwerte und bei 2 Patienten kam es zu schwerwiegenden Nebenwirkungen, so dass die Therapie abgebrochen werden musste. Aufgrund mangelnder Sicherheit wurde daraufhin das komplette Programm gestoppt.
GS-9190
In präklinischen Studien demonstrierte GS-9190 eine höhere antivirale Aktivität im Genotyp 1-Replikon als im Genotyp 2-Replikon. Aktuell wird die Substanz in einer Phase 1-Studie evaluiert.
BILB 1941
In einer Phase 1-Studie wurde BILB 1941 für 5 Tage als Suspension bei Patienten mit einer HCV-Genotyp 1 Infektion als Monotherapie verabreicht.31 Ein mit der Dosis steigende antivirale Effektivität wurde durch zunehmende gastrointestinale Beschwerden limitiert, weshalb die weitere Entwicklung der Substanz gestoppt wurde.
FAZIT UND AUSBLICK
Information zu Studien
Informationen zu laufenden Studien, z.B. Studiendesign, Studienzentren usw. findet man auf der amerikanischen Webseite www.clinicaltrials.gov. Dort sind in der Regel auch Adressen und Ansprechpartner der einzelnen Studienzentren aufgelistet. Leider sind die Angaben nicht immer vollständig, insbesondere was Studienzentren außerhalb den USA betrifft. Bei Interesse gibt auch das Studienzentrum der Medizinischen Klinik I der Universität Frankfurt Auskunft. Dr. Nicole Forestier Phone: +49-(0)-69-6301-5212
Die antivirale Effektivität der direkt antiviralen Substanzen hat das Therapieprinzip der STAT-C eindrucksvoll bestätigt. Die Daten der ersten abgeschlossenen Phase 2-Studien lassen auf eine circa 20prozentige Steigerung der dauerhaften Ansprechraten bei der chronischen Hepatitis C Genotyp 1 mit einer gleichzeitigen Reduktion der Therapiedauer auf 24 Wochen bei der Ersttherapie hoffen. Für Non-Responder sehen die Daten weniger gut aus. Hier konnte der Einsatz eines Proteaseinhibitors zwar ebenfalls das dauerhafte Ansprechen steigern, von einem Durchbruch kann allerdings angesichts einer Heilungsrate von ca. 14% in dieser schwierigen Patientengruppe sicherlich noch nicht die Rede sein. Die ersten Ergebnisse aus der PROVE 3-Studie mit einer SVR 12 von insgesamt 52% lässt jedoch hoffen, dass die dauerhaften Ansprechraten auch bei Problempatienten noch zu verbessern sind und dass insbesondere Ansätze mit der Kombination verschiedener direkt antiviraler Substanzen bleiben abzuwarten. Schließlich liegen bisher fast ausschließlich Daten zu HCV Genotyp 1 vor. Aufgrund der relativ hohen Variabilität der HCV-NS3 Protease zwischen den verschiedenen HCV-Genotypen werden die bisher entwickelten Proteaseinhibitoren vermutlich relativ genotyp-spezifisch wirksam sein. Im Gegensatz dazu könnten nukleosidische und nicht-nukleosidische Polymeraseinhibitoren aufgrund der hohen Konservierung der NS5B Polymerase bei verschiedenen Genotypen bei allen HCV-Genotypen effektiv sein. Studienergebnisse hierzu liegen jedoch noch nicht vor.
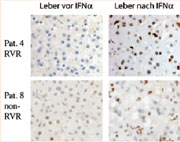
Mittels immunhistochemischer Färbung lassen sich aktivierte Leberzellkerne an einem bräunlichen Farbton erkennen. Bei einem Patienten mit gutem Ansprechen auf pegIFN alfa (obere zwei Bilder) verursacht erst die Behandlung eine deutliche Aktivierung in Leberzellkernen. Bei schlechtem Ansprechen (untere zwei Bilder) zeigt sich hingegen schon vor der Therapie eine charakteristische Färbung in den Zellkernen; die Behandlung führt lediglich zu einer zusätzlichen Aktivierung in den Leber-Fresszellen.
Markus H. Heim/Universität Basel
HCV: Warum wirkt Interferon manchmal nicht?
Nur die Hälfte der Patienten mit chronischer Hepatitis C kann mit der heute üblichen Interferon-Therapie geheilt werden. Weshalb die Behandlung oft nicht wirksam ist, konnten nun Wissenschaftler der Universität Basel durch die Untersuchung von Gewebeproben nachweisen. Das Forscherteam des Universitätsspitals Basel und des Friedrich Miescher Instituts untersuchten Leberbiopsien von 16 Patienten, die vier Stunden nach der ersten Injektion von pegIFNalfa entnommen wurden. Dabei zeigte sich, dass bei vielen Patienten bereits vor der Therapie die Zielgene aktiviert sind, die durch die Interferone stimuliert werden sollen. Bei ihnen blieb eine nennenswerte Wirkung von pegIFNalfa in den Leberzellen aus. Im Verlauf der weiteren Therapie zeigte sich auch keine Wirkung auf das Virus, und die Patienten konnten nicht geheilt werden.
Im Gegensatz dazu zeigten die Patienten, die vor der Behandlung keine Aktivierung des körpereigenen Interferonsystems aufwiesen, eine starke Wirkung von pegIFNalfa mit einer Induktion von hunderten von Zielgenen. Die Therapie führte bei der überwiegenden Zahl dieser Patienten schon nach vier Wochen zu einer Elimination des Virus. Aus der Literatur ist bekannt, dass 85% solcher Patienten geheilt werden.
Die Studie der Schweizer Forscher wurde in "Proceedings of the National Academy of Sciences" publiziert. RPV
Quelle: Universität Basel, Pressemitteilung vom 09.05.2008
Referenzen:
1. Fried MW, Shiffman ML, Reddy KR, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. The New England journal of medicine 2002;347(13):975-82.
2. Manns MP, McHutchison JG, Gordon SC, et al. Peg-interferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial. Lancet 2001;358(9286):958-65.
3. Berg T, von Wagner M, Nasser S, et al. Extended treatment duration for hepatitis C virus type 1: comparing 48 versus 72 weeks of peginterferon-alfa-2a plus ribavirin. Gastroenterology 2006;130(4):1086-97.
4. Zeuzem S, Buti M, Ferenci P, et al. Efficacy of 24 weeks treatment with peginterferon alfa-2b plus ribavirin in patients with chronic hepatitis C infected with genotype 1 and low pretreatment viremia. Journal of hepatology 2006;44(1):97-103.
5. von Wagner M, Huber M, Berg T, et al. Peginterferon-alpha-2a (40KD) and ribavirin for 16 or 24 weeks in patients with genotype 2 or 3 chronic hepatitis C. Gastroenterology 2005;129(2):522-7.
6. Mangia A, Santoro R, Minerva N, et al. Peginterferon alfa-2b and ribavirin for 12 vs. 24 weeks in HCV genotype 2 or 3. The New England journal of medicine 2005;352(25):2609-17.
7. Shiffman ML, Suter F, Bacon BR, et al. Peginterferon alfa-2a and ribavirin for 16 or 24 weeks in HCV genotype 2 or 3. The New England journal of medicine 2007;357(2):124-34.
8. Zeuzem S, Hultcrantz R, Bourliere M, et al. Peginterferon alfa-2b plus ribavirin for treatment of chronic hepatitis C in previously untreated patients infected with HCV genotypes 2 or 3. Journal of hepatology 2004;40(6):993-9.
9. Gish RG, Arora S, Rajender Reddy K, et al. Virological response and safety outcomes in therapy-nai ve patients treated for chronic hepatitis C with taribavirin or ribavirin in combination with pegylated interferon alfa-2a: a randomized, phase 2 study. Journal of hepatology 2007;47(1):51-9.
10. Hinrichsen H, Benhamou Y, Wedemeyer H, et al. Short-term antiviral efficacy of BILN 2061, a hepatitis C virus serine protease inhibitor, in hepatitis C genotype 1 patients. Gastroenterology 2004;127(5):1347-55.
11. Reiser M, Hinrichsen H, Benhamou Y, et al. Antiviral efficacy of NS3-serine protease inhibitor BILN-2061 in patients with chronic genotype 2 and 3 hepatitis C. Hepatology (Baltimore, Md 2005;41(4):832-5.
12. Lu L, Pilot-Matias TJ, Stewart KD, et al. Mutations conferring resistance to a potent hepatitis C virus serine protease inhibitor in vitro. Antimicrobial agents and chemotherapy 2004;48(6):2260-6.
13. Reesink HW, Zeuzem S, Weegink CJ, et al. Rapid decline of viral RNA in hepatitis C patients treated with VX-950: a phase Ib, placebo-controlled, randomized study. Gastroenterology 2006;131(4):997-1002.
14. Sarrazin C, Kieffer TL, Bartels D, et al. Dynamic hepatitis C virus genotypic and phenotypic changes in patients treated with the protease inhibitor telaprevir. Gastroenterology 2007;132(5):1767-77.
15. Forestier N, Reesink HW, Weegink CJ, et al. Antiviral activity of telaprevir (VX-950) and peginterferon alfa-2a in patients with hepatitis C. Hepatology (Baltimore, Md 2007;46(3):640-8.
16. Kieffer TL, Sarrazin C, Miller JS, et al. Telaprevir and pegylated interferon-alpha-2a inhibit wild-type and resistant genotype 1 hepatitis C virus replication in patients. Hepatology (Baltimore, Md 2007;46(3):631-9.
17. Forestier N WC, Purdy S, McNair L, Jansen P, Zeuzem S, Reesink H. Current Status Of Subjects Receiving Peg-Interferon-Alfa-2A (Peg-IFN) And Ribavirin (RBV) After A 14-Day Study Of The Hepatitis C Protease Inibitor Telaprevir (VX-950), With Peg-IFN. Hepatology (Baltimore, Md 2006;44(S1):Abstract 1142.
18. McHutchison JG, Everson G.T, al. MAe. PROVE1: Results from a Phase 2 Study of Telaprevir with Peginterferon alfa-2a and Ribavirin in Treatment-Naive Subjects with Hepatitis C. Journal of hepatology 2008;48, Suppl.2:S4.
19. Dusheiko G.M, Hezode C, al. ZSe. Treatment of chronic Hepatitis C with Telaprevir in Combination with Peginterferon alfa-2a with or without Ribavirin. Journal of hepatology 2008;48, Suppl.2:S26.
20. Malcolm BA, Liu R, Lahser F, et al. SCH 503034, a mechanism-based inhibitor of hepatitis C virus NS3 protease, suppresses polyprotein maturation and enhances the antiviral activity of alpha interferon in replicon cells. Antimicrobial agents and chemotherapy 2006;50(3):1013-20.
21. Sarrazin C, Rouzier R, Wagner F, et al. SCH 503034, a novel hepatitis C virus protease inhibitor, plus pegylated interferon alpha-2b for genotype 1 nonresponders. Gastroenterology 2007;132(4):1270-8.
22. gov CT. SCH503034 plus Peg-intron, with and without added ribavirin, in patients with chronic hepatitis C, genotype 1, who did not respond to previous treatment. 2007.
23. Kwo PY, Albrecht J, et al. Interim Results for HCV-SPRINT-1: RVR/EVR from phase 2 study of Boceprevir plus Pegintron/Ribavirin in treatment-naive subjects with genotype 1 CHC. Journal of hepatology 2008;48(Supplement 2):S372.
24. Reesink HVRSea. Safety of the HCV Protease Inhibitor TMC435350 in Healthy Volunteers and Safety and Activity in chronic Hepatitis C infected Individuals: A Phase I Study. Journal of hepatology 2008;48, Suppl. 2:S28.
25. XJ Z, Afdhal N, et al. Pharmacokinetics and pharmacodynamics of valopicitabine. Journal of hepatology 2005;42:229A.
26. Lawitz E, Nguyen T. Clearance of HCV-RNA with valopicitabine plus peginterferon in treatment-naive patients with HCV-1 infection. Journal of hepatology 2007;46:9A.
27. Afdhal N, Godofsky E, et al. Valopicitabine alone or with peginterferon compared to peginterferon/ribavirin retreatment in patients with HCV-1 infection and prior non-response to peg/rbv. Journal of hepatology 2007;46:9A.
28. Coelmont L, Paeshuyse J, Windisch MP, De Clercq E, Bartenschlager R, Neyts J. Ribavirin antagonizes the in vitro anti-hepatitis C virus activity of 2'-C-methylcytidine, the active component of valopicitabine. Antimicrobial agents and chemotherapy 2006;50(10):3444-6.
29. Nelson D, Hill G, et al. High End-of-treatment response (84%) after 4 weeks of R1626, Peginterferon alfa-2a and ribavirin followed by a further 44 weeks of Peginterferon alfa-2a and ribavirin. Journal of hepatology 2008;48(Supplement 2):S371.
30. Lalezari J, McHutchison JG, et al. Potent antiviral activity of the HCV nucleoside polymerase inhibitor R7128 with Peg-IFN and ribavirin: Interim results of R7128 500 mg BID for 28 days. Journal of hepatology 2008;48(Supplement 2):S29.
31. Erhardt A, Wedemeyer H. Safety, pharmacokinetics and antiviral effect of BILB 1941. Journal of hepatology 2007;44:222.