T. GÖBEL UND PD DR. A. ERHARDT
Leitlinien zur Prophylaxe, Diagnostik und Therapie der Hepatitis B Virus-Infektion - eine Zusammenfassung
Seit der Verabschiedung der letzten Leitlinie und deren Publikation im Jahre 2004 wurden wesentliche Fortschritte in der antiviralen Therapie der Hepatitis B erzielt, die ein Upgrade der Leitlinien erforderlich machten. Das Upgrade der Leitlinie berücksichtigt zudem die neuen Erkenntnisse zum HBV Genotyp, zur Viruskinetik unter Therapie und zur Bedeutung der Viruslast für den natürlichen Verlauf der Erkrankung. Eine Viruslast von 104 Kopien/ml bzw. 2.000 IU/ml stellt einen entscheidenden und unabhängigen Risikofaktor für die Entstehung der Leberzirrhose und des hepatozellulären Karzinoms dar.
Im Vorspann der Konsensus-Empfehlungen werden die verschiedenen Verlaufsformen der Hepatitis B-Virus definiert, wobei insbesondere die Hepatitis B mit Leberzellschaden von einer HBV-Infektion ohne Leberzellschaden differenziert wurde (Tab. 1).
DIAGNOSTIK DER HEPATITIS B
Chronische Hepatitis B
Persistierende HBV Infektion, die mit einer Leberzellschädigung einhergeht, die biochemisch und/oder histologisch nachweisbar ist.
Hochvirämischer ("immuntoleranter") HBsAg Trägerstatus
Hochreplikative, chronische HBV Infektion ohne Zeichen der Leberzellschädigung, meist nach vertikaler Übertragung oder Infektion im Kleinkindesalter. Übergang in eine chronische Hepatitis B ist möglich.
Niedrigvirämischer ("inaktiver") HBsAg Trägerstatus
Persistierende HBV Infektion ohne Zeichen der Leberzellschädigung. Der inaktive HBsAg Träger ist HBeAg-negativ und niedrig replikativ. Risiko der Reaktivierung der Erkrankung (Hepatitis) im Spontanverlauf oder unter Immunsuppression.
Grundsätzlich wird in der Leitlinie zur Diagnostik zwischen HBV-Screening, prätherapeutischer Diagnostik und Verlaufsdiagnostik während der Therapie unterschieden. Dem Konsensus-Panel erschien es wichtig, dass Screeningmaßnahmen großzügig durchgeführt werden und beispielsweise Patienten mit Migrationshintergrund aus Regionen mit erhöhter HBs-Ag-Prävalenz verstärkt in das Screening mit aufgenommen werden. HBsAg und Anti-HBs bleiben die wichtigsten Parameter beim Screening auf eine chronische HBV-Infektion. Wenn HBsAg positiv ist, folgen in einem abgestimmten Stufenschema weitere diagnostische Parameter wie HBeAg, Anti-HBe, Anti-HBc und HBV-DNA. Beim Nachweis von HBsAg sollte zudem immer auf eine Hepatitis Delta-Virusinfektion mittels Hepatitis Delta-Antikörper untersucht werden. Zur Erstdiagnostik bei Hepatitis B-Virusinfektion gehören ferner der Ausschluss weiterer Koinfektionen wie HIV und HCV sowie die Erhebung des Hepatitis A-Serostatus.
Insgesamt kommt der quantitativen HBV-DNA-Bestimmung große Bedeutung zu, nicht nur für die Differenzierung zwischen hochvirämischen und niedrigvirämischen Patienten und deren Bedeutung für das Therapieansprechen, sondern auch aufgrund der zunehmenden Erkenntnisse zur Bedeutung der HBV-DNA für den natürlichen Krankheitsverlauf. Die HBV-Virus-last sollte regelmäßig bestimmt werden. Neu ist ferner die Messung der HBV-Kinetik für das Therapiemonitoring. Die quantitative HBV-DNA sollte bereits vier bis sechs Wochen sowie 12 Wochen nach Therapiebeginn und dann alle drei bis sechs Monate bestimmt werden. Ein fehlender Abfall der Viruslast (primäres Therapieversagen) oder ein erneuter Anstieg der Virämie (sekundäres Therapieversagen) sollte zur Bestimmung von Resistenzmutationen im HBV-Polymerasegen Anlass geben, wenn mit einem Nukleos(t)idanalogon behandelt wird.
Neuer Bestandteil der HBV-Leitlinie ist auch die prätherapeutische Bestimmung des HBV-Genotyps, da sich für die Interferontherapie deutliche Unterschiede im Therapieansprechen zwischen den Hepatitis B-Virus-Genotypen nachweisen ließen.
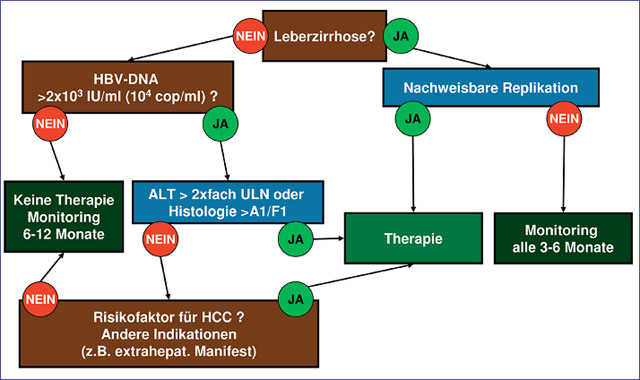 Abb. 1: Indikation zur Therapie
Abb. 1: Indikation zur Therapie
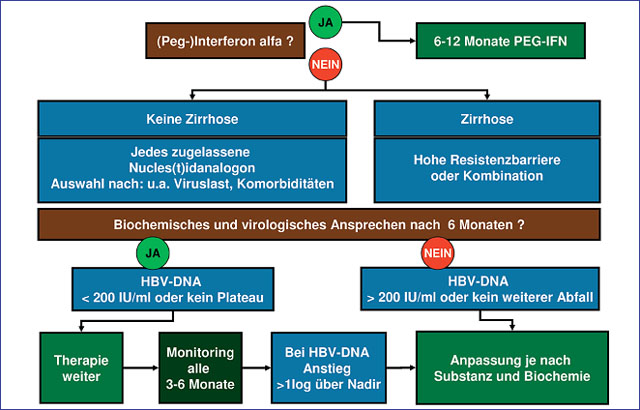 Abb. 2: Therapie im Überblick
Abb. 2: Therapie im Überblick
THERAPIEINDIKATION
In aller Regel behandlungsbedürftige Patienten:
HBV-DNA =104 Kopien/ml (>2 x103 IU/ml), ALT/GPT =2 ULN oder Histologie > minimale entzündliche Aktivität/geringe Fibrose
Besonders behandlungsbedürftige Patienten:
HBV-DNA-positive Patienten mit deutlicher oder fortschreitender Fibrose
Patienten mit (dekompensierter) Zirrhose bei Virusnachweis
In der Regel nicht behandlungsbedürftige Patienten:
HBsAg-Träger:
wiederholt HBV-DNA-negativ oder sehr niedrige HBV-DNA-Konzentrationen (<104 Kopien/ml), wiederholt
normale Transaminasen und höchstens minimale entzündliche Aktivität/geringe Fibrose in der
Leberbiopsie
| Substanz | Zugelassene Dosierung |
|---|---|
| Alfa-Interferone | |
| Pegyliertes Interferon alfa-2a (Pegasys®) |
180µg 1x wö. für 48 Wochen |
| Interferon alfa-2a (Roferon®) | 2,5-5 Mio. IU pro m² Körperoberfläche 3x wö. f. 4-6 Monate |
| Interferon alfa-2b (Intron A®) | 5-10 Mio. IU 3x/ Woche (jeden 2. Tag) s.c. 4-6 Monate |
| Nukleosidanaloga: | |
| Lamivudin (Zeffix®) | 100 mg einmal täglich |
| Entecavir (Baraclude®) | 0,5 mg einmal täglich 1,0 mg bei Patienten mit Lamivudin-Vortherapie |
| Telbivudin (Sebivo®) | 600 mg einmal täglich |
| Nukleotidanaloga: | |
| Adefovir dipivoxil (Hepsera®) | 10 mg einmal täglich |
| Tenofovir disoproxil (Viread®)* | 245 mg einmal täglich |
Hepatitis B zugelassen sind und/oder die Zulasssung erwartet*
wird (Stand 01.06.2007)
Die akute Hepatitis B stellt aufgrund der hohen Spontanheilungsrate bei Erwachsenen keine Indikation zur Therapie dar. Sonderfälle bleiben Patienten mit fulminanter Hepatitis, bei denen eine antivirale Behandlung mit Nukleos(t)idanaloga sowie ggf. eine frühzeitige Vorstellung in einem Transplantationszentrum empfohlen wird.
Bei der chronischen Hepatitis B richten sich die neuen Konsensus-Empfehlungen im Gegensatz zu den früheren Leitlinien nicht mehr nach dem HBe-Antigenstatus, sondern vielmehr nach der Höhe der HBV-DNA, der entzündlichen Aktivität und dem Fibrosestadium. (Tab. 2).
Eine HBV-DNA von >104 Kopien/ml bzw. 2.000 IU/ml gilt bei Patienten mit erhöhten Transaminasen oder entzündlicher Aktivität in der Histologie als Indikation zur Behandlung. Als besonders behandlungsbedürftig gelten Patienten mit fortgeschrittener Fibrose oder Zirrhose. Bei diesen Patienten wird eine antivirale Therapie unabhängig von Viruslast und Transaminasenhöhe empfohlen, denn die antivirale Behandlung vermindert das Risiko einer Dekompensation und der Entstehung eines HCCs. Für Patienten mit Alkohol- und Drogenkonsum wurde die Indikation zur antiviralen Therapie aufgrund der guten Verträglichkeit der oralen antiviralen Medikamente weiter gefasst, wobei Abstinenz und Compliance weiterhin wichtige Kriterien bleiben.
THERAPIE DER HEPATITIS B
Bei der Auswahl der Medikamente zur Therapie der Hepatitis B empfiehlt die Leitlinie, zunächst zu prüfen, ob eine Alfa-Interferontherapie möglich und sinnvoll ist (Abb. 1). Die Therapie mit Interferonen ist grundsätzlich zeitlich begrenzt, ermöglicht ein dauerhaftes Ansprechen in 20-40% der Patienten und ist mit keiner Resistenzentwicklung verbunden. Faktoren, die mit einem guten Interferonansprechen assoziiert sind, sind ein günstiger HBV-Genotyp (Genotyp A), eine niedrige Viruslast (<105 IU/ml) sowie eine mindestens 2fache Erhöhung der Transaminasen (ideal mindestens 5fache Erhöhung der Transaminasen). Interferone können nicht angewendet werden bei fortgeschrittener Leberzirrhose und Schwangerschaft und sind bei Patienten mit einem Drogenabusus eher zurückhaltend einzusetzen (Tab. 3).
Ist eine Interferontherapie nicht möglich, können Nukleos(t)idanaloga als Hemmer der HBV-Polymerase eingesetzt werden. Voraussetzung für die Therapie mit Nukleos(t)idanaloga ist die Kenntnis der viralen Effektivität, der Resistenzbarriere und des Resistenzprofils. Für Nukleos(t)idanaloga gilt, dass die HBe-Serokonversionsraten im Langzeitverlauf zunehmen und bei einer Lamivudin- oder Adefovir-Therapie bis zu 50% nach fünf Jahren betragen. Die höchsten Serokonversionsraten zeigen hier Patienten mit hohen Transaminasen, niedriger Viruslast und jungem Lebensalter. Grundsätzlich können alle Nukleos(t)idanaloga eingesetzt werden. Insbesondere bei Patienten mit Leberzirrhose wird eine Substanz mit hoher Resistenzbarriere bzw. eine Kombinationstherapie empfohlen.
KOMBINATIONSTHERAPIE
| Nicht ausreichendes Therapieansprechen | Therapieoption1 |
|---|---|
| Lamivudin | Entecavir Adefovir Tebivudin Tenofovir1 |
| Adefovir bei Lamivudin- naiven Patienten |
Entecavir Telbivudin Lamivudin Tenofovir1 |
| Adefovir bei Lamivudin- vorbehandelten Patienten |
Wechsel von Adefovir auf Tenofovir1 Zugabe von Entecavir (unter Beibehaltung von Adefovir) |
| Adefovir unter kombinierter Therapie mit Lamivudin | Wechsel von Adefovir auf Tenofovir1 Wechsel von Lamivudin auf Entecavir |
| Entecavir | Adefovir Tenofovir1 |
| Telbivudin | Adefovir Entecavir Tenofovir1 |
| Tenofovir | Entecavir Telbivudin Lamivudin |
| 1 Tenofovir ist 2007 noch nicht zur Therapie der Hepatitis B zugelassen, prinzipiell aber wirksam und daher als Therapieoption mit einbezogen. | |
ausreichendem virologischen Ansprechen unter einer
Nukleos(t)idanaloga-Monotherapie (nach sechs Monaten
Therapie noch >103 Kopien HBV-DNA/ml (200 IU/ml)
oder kein fortgesetzter Abfall der HBV-DNA
| Resistenz | Therapieoption1 |
|---|---|
| Lamivudin-Resistenz | Zugabe von Adefovir Zugabe von oder Wechsel auf Tenofovir1 (Wechsel zu Entecavir) |
| Adefovir-Resistenz bei Lamivudin-naiven Patienten | Zugabe von Entecavir Zugabe von Telbivudin Zugabe von Lamivudin |
| Adefovir-Resistenz bei Lamivudin vorbehandelten Patienten | Zugabe von Entecavir Wechsel von Adefovir auf Tenofovir1 |
| Adefovir-Reistenz unter kombinierter Therapie mit Lamivudin | Wechsel von Lamivudin auf Entecavir Wechsel von Adefovir auf Tenofovir1 |
| Entecavir-Resistenz | Zugabe von Adefovir Zugabe von Tenofovir1 |
| Telbivudin-Resistenz | Zugabe von Adefovir Zugabe von Tenofovir1 (Wechsel auf Entecavir) |
| Tenofovir-Resistenz | Zugabe von Entecavir Zugabe von Telbivudin Zugabe von Lamivudin |
| 1 Tenofovir ist 2007 noch nicht zur Therapie der Hepatitis B zugelassen, prinzipiell aber wirksam und daher als Therapieoption mit einbezogen. | |
HBV-Resistenzentwicklung (Anstieg der HBV-DNA >1 log
über Nadir) im Verlauf einer Nukleos(t)idanaloga-Therapie
Die Kombination von Interferon mit einem Nukleos(t)id war in klinischen Studien der alleinigen Gabe von Interferon nicht überlegen und wird daher nicht empfohlen. Auch die Kombination zweier Nukleos(t)idanaloga führt in der Regel nicht zu einer Potenzierung des virologischen und biochemischen Ansprechens, sondern entspricht den Ansprechraten des virologisch potentesten Medikamentes. Kombinationstherapien mit Nukleos(t)idanaloga zeigen jedoch in ersten Untersuchungen eine niedrigere Rate an Resistenzen, wobei das Auftreten von Resistenzen aber nicht gänzlich verhindert werden kann. Vor diesem Hintergrund empfiehlt die Leitlinie nicht grundsätzlich eine Kombinationstherapie. Eine primäre Kombinationstherapie ist vor allem bei Patienten mit Leberzirrhose und/oder bei der HBV/HIV-Koinfektion eine Option. Eine sekundäre Kombinationstherapie nach Auftreten von Resistenzen ist dagegen bei einer Vielzahl von Nukleos(t)idanaloga im Sinne eines Add-on empfohlen (Tab. 4 und 5).
THERAPIEVERLAUF
Entscheidend bei der Therapie der Hepatitis B ist die engmaschige Therapieüberwachung (Abb. 2). Das biochemische und virologische Ansprechen bei einer Therapie mit Nukleos(t)idanaloga sollte zunächst vier bis sechs Wochen nach Therapiebeginn und später alle drei Monate kontrolliert werden. Als ausreichendes Ansprechen auf die Therapie wird ein Abfall der HBV-DNA <1.000 Kopien/ml bzw. 200 IU/ml nach sechs Monaten angesehen der ein kontinuierlicher Abfall der HBV-DNA bis zum Monat sechs bzw. 12. Bei Nichtansprechen sollte man eine Umstellung der oralen Therapie unter Berücksichtigung der Compliance erwägen.
Die Behandlung mit Nukleos(t)idanaloga sollte bei HBeAg-positiven Patienten nach erfolgter HBe-Serokonversion für mindes-tens sechs, besser für 12 Monate weitergeführt werden. Die Therapiedauer bei HBeAg-negativen Patienten unter oraler Nukleos(t)idtherapie ist nicht genau definiert. In der Regel wird hier eine Dauertherapie notwendig sein. Die orale antivirale Therapie kann allerdings in jedem Fall beendet werden, wenn eine HBs-Serokonversion mit Ausbildung eines Anti-HBs-Titers von >100 IU/ml eingetreten ist.
RESISTENZ
Die Leitlinien beinhalten erstmals konkrete Empfehlungen zur Therapieanpassung bei HBV-Resistenzentwicklung für verschiedene Nukleos(t)idanaloga, wobei zwischen primärem Nichtansprechen und sekundärer Resistenzentwicklung differenziert wird. Von einem primären virologischen Nichtansprechen wird ausgegangen, wenn die HBV-DNA nach einer 3-monatigen Therapie nicht um mindestens 1 log Stufe abgefallen ist. Von einem sekundären Versagen muss man ausgehen, wenn unter fortgesetzter antiviraler Therapie die HBV-DNA um mindestens 1 log-Stufe vom Nadir ansteigt. Hauptursachen sind die ungenügende Compliance und Resistenzentwicklung. In diesem Fall ist eine Resis-tenztestung indiziert, um frühzeitig eine Therapieumstellung einleiten zu können.
THERAPIE BEI ORGANTRANSPLANTATION
Zur Reinfektionsprophylaxe mit dem Hepatitis B-Virus nach erfolgter Lebertransplantation wird eine Kombinationstherapie mit einem Nukleos(t)idanalogon und Hepatitis B-Immunglobulin empfohlen. Entsprechend den allgemeinen Leitlinien wird bei Patienten mit hoher Replikation ein Nukleos(t)idanalogon mit hoher antiviraler Potenz und hoher Resistenzbarriere empfohlen. Hinsichtlich der HBIG-Prophylaxe sollte ein Anti-HBs-Spiegel von 100 U/l nicht unterschritten werden. Die Therapiekontrollen entsprechen denen bei nicht-transplantierten Patienten.
Bei HBs-Ag-positiven Patienten, bei denen nicht die Leber, sondern ein anderes Organ transplantiert wurde, genügt eine Therapie mit Nukleos(t)idanaloga. Isoliert Anti-HBc-positive bzw. anti-HBc/anti-HBs-positive Patienten benötigen bei anderen Organtransplantationen als einer Lebertransplantation gemäß den Konsensus-Empfehlungen keine antivirale Therapie. Anders ist dies im Fall einer Knochenmarks- oder Stammzelltransplantation. Hier sollte die Prophylaxe spätestens im Zusammenhang vorheriger Chemotherapie eingeleitet und mindestens sechs Monate über die Immunrekonstitution hinaus fortgeführt werden.
HBV-KOINFEKTION
Die Konsensus-Empfehlungen sehen vor, dass bei Patienten mit HBV-Koinfektion (HBV/HDV, HBV/HCV, HBV/HIV, HBV/Triple-Infektionen) die Indikation zur antiviralen Therapie bei Patienten mit entzündlicher Aktivität und/oder Fibrose großzügig gestellt wird. Grund dafür ist die in der Regel raschere Fibroseprogression und höhere Komplikationsrate der Zirrhose bei diesen Patienten.
Bei der Hepatitis D wird eine Behandlung mit pegyliertem Interferon über die Dauer von mindestens 12 (besser 24) Monaten angeraten.
Bei der chronischen replikativen Hepatitis C mit inaktivem HBs-Trägerstatus sollte die Therapieindikation, Auswahl und Dauer der Medikamente wie bei alleiniger Hepatitis C erfolgen, während bei gleichzeitig hochvirämischer Hepatitis B eine Therapie mit pegyliertem Interferon-alfa und Ribavirin über 48 Wochen durchgeführt werden sollte. Nach erfolgloser Interferon- oder Interferon-Ribavirin-Therapie sollte bei Persistenz der Hepatitis B-Virämie zumindest die Hepatitis B nach den allgemeinen Leitlinien effektiv weiterbehandelt werden, wobei sich insbesondere Nukleos(t)idanaloga anbieten.
Bei HIV-Koinfizierten muss man die Wirksamkeit der Nukleos(t)idanaloga gegen HIV und die damit mögliche HIV-Resistenzentwicklung berücksichtigen. Im Falle einer HIV-Behandlung sollte man bei der HAART (Highly Active Antiretroviral Therapy) bevorzugt zwei Reverse Transkriptasehemmer einsetzen, die gegen HIV und HBV wirken. Sofern keine HAART notwendig ist, empfiehlt sich ein Nukleos(t)idanalogon ohne gleichzeitige HIV-Wirksamkeit.
PD Dr. A. Erhardt · Universitätsklinikum Düsseldorf
Klinik für Gastroenterologie,
Hepatologie und Infektiologie
Moorenstraße 5 · 40225 Düsseldorf
Tel.: 0211-8118268
Fax: 0211-8118132
E-Mail: Erhardt@med.uni-duesseldorf.de
Literatur
Cornberg M, Protzer U, Dollinger MM, Petersen J, Wedemeyer H, Berg T, Jilg W, Erhardt A, Wirth S,
Schirmacher P, Fleig WE, Manns M. Prophylaxe, Diagnostik und Therapie der Hepatitis-B-Virus-(HBV-)
Infektion. Z. Gastroenterol 2007; 45:1-51.
Zusammenfassung
Die wesentlichen Änderungen der neuen Leitlinie zur Prophylaxe, Diagnostik und Therapie der Hepatitis B-Virusinfektion können auf folgende Punkte zusammengefasst werden:
- Der HBV-DNA Grenzwert von 2.000 IU/ml bzw. 10.000 Kopien/ml spielt eine wesentliche Rolle für die Indikationsstellung der Therapie und den natürlichen Verlauf.
- Bestimmungen des HBV-Genotyps, der Hepatitis-B-Viruslast vor Therapie und der Viruskinetik sind wesentliche Bestandteile für eine rationale Therapieplanung und Therapieüberwachung.
- Interferone sollten aufgrund der Möglichkeit einer definitiven Therapie in der Erstlinientherapie erwogen werden.
- Im Falle einer Therapie mit Nukleos(t)idanaloga sollte dies unter Kenntnis der antiviralen Effektivität, der Resistenzbarriere und des Resistenzprofils erfolgen