Sofosbuvir/Ledipasvir (Harvoni®)
Filmtablette 400/90 mg
Indikation
Harvoni
wird bei Erwachsenen zur Behandlung der chronischen Hepatitis C (CHC)
angewendet
(siehe
Abschnitte 4.2, 4.4 und5.1).
Zur
spezifischen Aktivität gegen die verschiedenen Genotypen des
Hepatitis-C Virus(HCV)
(siehe
Abschnitte 4.4 und 5.1.).
Tabelle 1: Empfohlene Dauer der Behandlung mit Havroni und empfohlene kombinierte Anwendung mit Ribavirin bei bestimmten Subgruppen
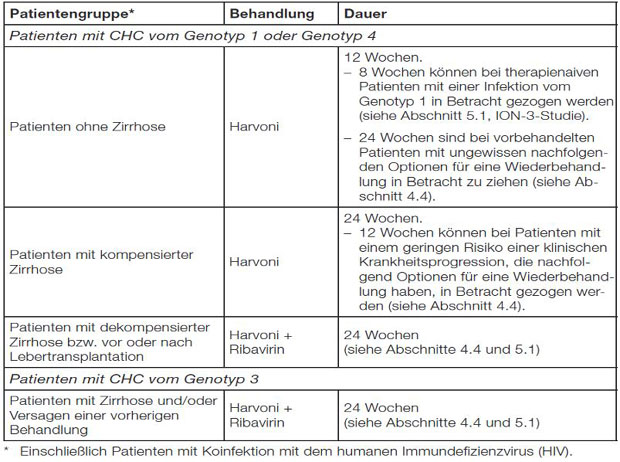
Tabelle 2: Richtlinie zur Dosisanpassung von Ribavirin bei gleichzeitiger Anwendung mit Havroni

Art der Anwendung
Zum Einnehmen. Die Patienten sind anzuweisen, die Tablette im Ganzen zu schlucken, unabhängig von einer Mahlzeit. Aufgrund des bitteren Geschmacks wird empfohlen, die Filmtablette weder zu zerkauen noch zu zerkleinern (siehe Abschnitt 5.2).
Interaktionen
Siehe Fachinfo sowie Interaktionsprofil Sofosbuvir/Ledipasvir
Nierenfunktionsstörung
Bei Patienten mit leichter oder mittelgradiger Nierenfunktionsstörung ist keine Dosisanpassung von Harvoni erforderlich. Bei
Patienten mit schwerer Nierenfunktionsstörung (geschätzte glomeruläre Filtrationsrate [eGFR] < 30 ml/min/1,73 m2) oder bei hämodialysepflichtigen Patienten mit einer terminalen Niereninsuffizienz (ESRD, end stage renal disease) wurde die Sicherheit von Ledipasvir/Sofosbuvir nicht untersucht (siehe Abschnitt 5.2).
Die hier genannten Informationen wurden gewissenhaft erstellt. Eine Gewähr für die Richtigkeit der gemachten Angaben kann trotz aller Bemühungen NICHT übernommen werden!