Daclatasvir (Daklinza®)
Siehe auch:
60 mg und 30 mg Filmtablette
Indikation
Zugelassen zur Behandlung der chronischen Hepatitis C bei Erwachsenen in Kombination mit anderen Arzneimitteln bei Genotyp 1-4.
Tabelle 1: Empfehlungen zu Behandlungsregimen und Behandlungsdauer für die Kombinationstherapie mit Daklinza
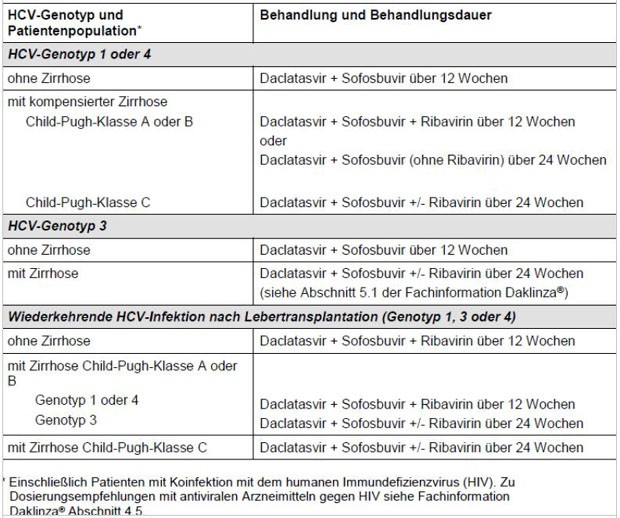
* Die Therapie-Empfehlung für Nicht-Zirrhotiker 12 Wochen DCV+SOF basiert auf der ALLY-3 Studie (Phase 3 Studie). Die Empfehlung für Zirrhotiker (alle Zirrhose-Grade) 24 Wochen DCV+SOF +/- RBV basiert auf Interim-Daten aus den verschiedenen Compassionate Use Programmen (und Extrapolation aus der Phase 2 Zulassungsstudie 040). Die "alte" Empfehlung "Genotyp 3 mit kompensierter Zirrhose und/oder behandlungserfahren" 24 Wochen DCV+SOF+RBV besteht somit nicht mehr.

Dosierung/Wechselwirkungen
Einmal eine Tablette 60 mg täglich mit oder ohne Mahlzeit.
Die Dosis sollte auf 30 mg einmal taglich reduziert werden, wenn es zusammenmit starken Inhibitoren von CYP3A4 angewendet wird. Zum Beispiel: 30 mg täglich in Kombination mit geboostertem Atazanavir, Cobicistat-enthaltender ART, Clarithromycin, Telithromycin und Ketokonazol.
Die Dosis sollte auf 90 mg einmal taglich erhoht werden, wenn es zusammenmit moderaten Induktoren von CYP3A4 angewendet wird. Zum Beispiel: In Kombination mit Efavirenz 90 mg täglich.
Verträglichkeit
Daclatasvir ist sehr gut verträglich.
Wirksamkeit bei Interferon-freier Kombination
Tabelle 5: Ansprechraten, Daclatasvir in Kombination mit Sofosbuvir, HCV-Genotyp 1
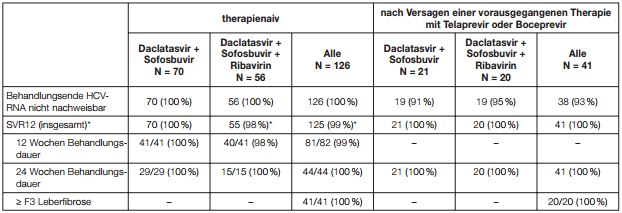
* Patienten mit fehlenden Daten zum Zeitpunkt Woche 12 nach Behandlungsende wurden als Responder gewertet, wenn ihr nächster verfügbarer HCV-RNA-Wert < LLOQ war. Für einen therapienaiven Patienten fehlten sowohl die Daten zum Zeitpunkt Woche 12 nach Behandlungsende als auch zu Woche 24.
Tabelle 6: Ansprechraten, Daclatasvir in Kombination mit Sofosbuvir für 24 Wochen; therapienaive Patienten mit HCV-Genotyp 2 oder 3
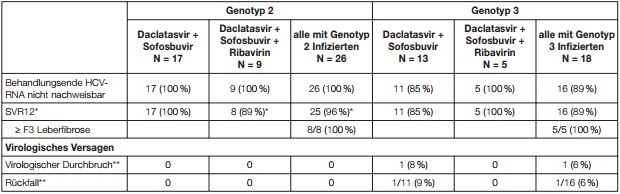
* Patienten mit fehlenden Daten zum Zeitpunkt Woche 12 nach Behandlungsende wurden als Responder gewertet, wenn ihr nächster verfügbarer HCV-RNA-Wert <LLOQ war. Für einen Patient infiziert mit Genotyp 2 fehlten sowohl die Daten zum Zeitpunkt Woche 12 nach Behandlungsende als auch zu Woche 24.
** Der Patient erfüllte die ursprünglich im Protokoll definierten Kriterien für einen
virologischen Durchbruch (bestätigter HCVRNA-Wert <LLOQ,
nachweisbar in der Behandlungswoche 8). Rückfall war
definiert als HCV-RNA ≥LLOQ während der Nachbeobachtung nach HCV-RNA <LLOQ
am Behandlungsende. Rückfall beinhaltet
alle Beobachtungen bis zur Nachbeobachtungswoche 24.
Bewertung/Einordnung/Nutzen
Mit Daclatasvir in Kombination mit Sofosbuvir ist eine hochwirksame, Interferon-freie Behandlung der Hepatitis C bei allen Genotypen möglich. Die Einnahme ist einfach, die Verträglichkeit sehr gut und das Interaktionspotential vergleichsweise gering. Studien mit größeren Patientenzahlen zeigen eine gute Wirksamkeit bei dem schwieriger zu behandelnden Genotyp 3.
Die hier genannten Informationen wurden gewissenhaft erstellt. Eine Gewähr für die Richtigkeit der gemachten Angaben kann trotz aller Bemühungen NICHT übernommen werden!